
| A. | Na+ | B. | O2- | C. | Mg2+ | D. | F- |
 同步轻松练习系列答案
同步轻松练习系列答案 课课通课程标准思维方法与能力训练系列答案
课课通课程标准思维方法与能力训练系列答案科目:高中化学 来源: 题型:实验题


查看答案和解析>>
科目:高中化学 来源: 题型:选择题
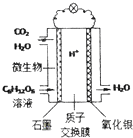 最近科学家研制的一种新型“微生物电池”可以将污水中的有机物转化为H2O和CO2,同时产生电能,其原理示意如图.下列有关该电池的说法正确的是( )
最近科学家研制的一种新型“微生物电池”可以将污水中的有机物转化为H2O和CO2,同时产生电能,其原理示意如图.下列有关该电池的说法正确的是( )| A. | 氧化银电极上反应为:Ag2O+2e-═2Ag+O2- | |
| B. | 石墨电极上反应为:C6H12O6+6H2O+24e-═6CO2↑+24H+ | |
| C. | 每转移4mol电子,氧化银电极产生22.4LCO2气体(标准状况) | |
| D. | 每30g C6H12O6参与反应,有4mo1 H+经质子交换膜进入正极区 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
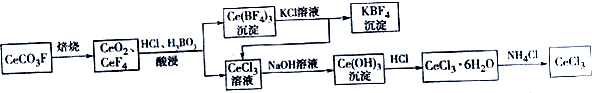
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
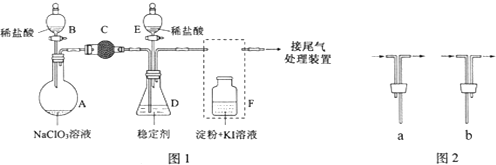
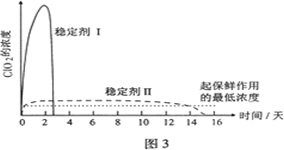
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 甲苯的结构式:C7H8 | B. | 乙烷的结构简式:CH3CH3 | ||
| C. | 甲醇的电子式:CH3OH | D. | 乙醇的分子式:CH3CH2OH |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | H2 | B. | CO2 | C. | Cl2 | D. | O2 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com