
| A. | 周期表是按各元素的相对原子质量递增的顺序从左到右排列的 | |
| B. | 元素周期表共有16个族,也就是16个纵行 | |
| C. | 同周期元素的电子层数相同 | |
| D. | 每一周期的元素都是从碱金属开始,以稀有气体结束 |
分析 A、周期表按照原子序数的递增及原子结构的周期性变化排列;
B、元素周期表共有18个纵行;
C、电子层相同的放在同一周期;
D、第一周期不含碱金属元素.
解答 解:A、周期表按照原子序数的递增及原子结构的周期性变化排列,与元素的相对原子质量无关,故A错误;
B、元素周期表共有18个纵行,1个第Ⅷ族三个纵行,故B错误;
C、电子层相同的放在同一周期,所以同周期元素的电子层数相同,故C正确;
D、第一周期不含碱金属元素,除第一周期外的每一周期的元素都是从碱金属开始,以稀有气体结束,故D错误;
故选C.
点评 本题考查元素周期表的结构及应用,为高频考点,把握元素位置、性质的关系为解答的关键,题目难度中等.


 小学课堂作业系列答案
小学课堂作业系列答案 金博士一点全通系列答案
金博士一点全通系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 该元素的原子序数是72 | B. | 该元素的原子序数是185 | ||
| C. | 该原子相对原子质量是185 | D. | 该元素是一种新元素 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.5xy2 | B. | xy | C. | xy2 | D. | 4xy2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 操作和现象 | 结论 | |
| A | 向纯碱中滴加足量浓盐酸,将产生的气体通入苯酚钠溶液,溶液变浑浊 | 酸性:盐酸>碳酸>苯酚 |
| B | 向某溶液中加入新制Cu(OH)2,加热出现红色沉淀 | 证明溶液中一定含醛类物质 |
| C | 取2mL 溴乙烷,加入适量NaOH水溶液,加热.一段时间后,向溶液中滴加AgNO3溶液,有淡黄色沉淀产生 | 溴乙烷中的Br变成了Br- |
| D | 取2mL 溴乙烷,加入适量NaOH乙醇溶液,加热.将产生的气体通入Br2的四氯化碳溶液中,溶液褪色 | 反应生成乙烯,溴乙烷与NaOH乙醇溶液发生消去反应 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 根据同周期元素的第一电离能变化趋势,推出Al的第一电离能比Mg大 | |
| B. | 根据主族元素最高正化合价与族序数的关系,推出卤族元素最高正价都是+7 | |
| C. | 根据同周期元素的电负性变化趋势,推出Ar的电负性比Cl大 | |
| D. | 根据较强酸可以制取较弱酸的规律,推出CO2通入NaClO溶液中能生成HClO |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 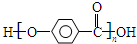 的结构中含有酯基 的结构中含有酯基 | |
| B. | 甲基的电子式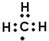 | |
| C. | 顺-2-丁烯和反-2-丁烯的加氢产物不同 | |
| D. | 用重结晶的方法提纯苯甲酸时应趁热过滤 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在化合物中呈现+2价 | B. | 它的氢氧化物呈两性 | ||
| C. | 原子半径在本族元素中最大 | D. | 单质与水反应能放出氢气 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①和③ | B. | ① | C. | ②和③ | D. | ②和④ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com