
汽车剧烈碰撞时,安全气囊中发生反应10NaN3+2KNO3===K2O+5Na2O+16N2↑。若氧化产物比还原产物多1.75 mol,则下列判断正确的是( )
A.生成42.0 L N2(标准状况)
B.有0.250 mol KNO3被氧化
C.转移电子的物质的量为1.25 mol
D.氧化产物的物质的量为3.75 mol
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
常温下,下列溶液中氢离子浓度最小的是
A.pH = 0的NaHSO4溶液 B.0.04 mol·L-1 硫酸
C.0.5 mol·L-1 盐酸 D.0.05 mol·L-1硝酸
查看答案和解析>>
科目:高中化学 来源: 题型:
从薄荷油中得到一种烃A(C10H16),叫α非兰烃,与A相关反应如下:
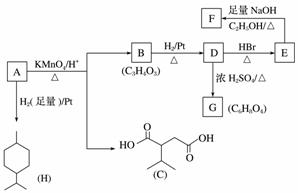
已知:
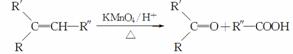
(1)H的分子式为____________。
(2)B所含官能团的名称为________。
(3)含两个—COOCH3基团的C的同分异构体共有____种(不考虑手性异构),其中核磁共振氢谱呈现2个吸收峰的异构体结构简式为____________________。
(4)B→D,D→E的反应类型分别为________、________。
(5)G为含六元环的化合物,写出其结构简式:____________________________________。
(6)F在一定条件下发生聚合反应可得到一种高吸水性树脂,该树脂名称为________。
(7)写出E→F的化学反应方程式:__________________________________________________
________________________________________________________________________。
(8)A的结构简式为____________,A与等物质的量的Br2进行加成反应的产物共有________种(不考虑立体异构)。
查看答案和解析>>
科目:高中化学 来源: 题型:
某恒温密闭容器中,可逆反应A(s)B+C(g) ΔH=+Q kJ·mol-1(Q>0)达到平衡。缩小容器体积,重新达到平衡时,C(g)的浓度与缩小体积前的平衡浓度相等。以下分析正确的是( )
A.产物B的状态只能为固态或液态
B.平衡时,单位时间内n(A)反应∶n(C)生成=1∶1
C.若开始时向容器中加入1 mol B和1 mol C,达到平衡时放出热量Q kJ
D.保持体积不变,向平衡体系中加入B,平衡可能向逆反应方向移动
查看答案和解析>>
科目:高中化学 来源: 题型:
化学平衡状态Ⅰ、Ⅱ、Ⅲ的相关数据如下表:
| 编号 | 化学方程式 | 平衡常数 | 温度 | |
| 979 K | 1 173 K | |||
| Ⅰ | Fe(s)+CO2(g)FeO(s)+CO(g) | K1 | 1.47 | 2.15 |
| Ⅱ | CO(g)+H2O(g)CO2(g)+H2(g) | K2 | 1.62 | b |
| Ⅲ | Fe(s)+H2O(g)FeO(s)+H2(g) | K3 | a | 1.68 |
根据以上信息判断,下列结论错误的是( )
A.a>b
B.增大压强,平衡状态Ⅱ不移动
C.升高温度,平衡状态Ⅲ向正反应方向移动
D.反应Ⅰ、Ⅲ均为放热反应
查看答案和解析>>
科目:高中化学 来源: 题型:
NA代表阿伏加德罗常数,在含4 g NaOH溶质的溶液中通入一定量的CO2,将溶液蒸干并灼烧,最后得到的固体可能是( )
A.0.1NA的NaHCO3
B.0.05NA Na2CO3
C.0.05NA~0.1NA Na2CO3和NaHCO3混合物
D.0.1NA的NaHCO3和NaOH混合物
查看答案和解析>>
科目:高中化学 来源: 题型:
短周期元素X、Y、Z、W在元素周期表中的相对位置如图所示。已知YW的原子充数之和是Z的3倍,下列说法正确的是
| Y | Z | ||
| X | W |
A.原子半径:X<Y<Z
B.气态氢化物的稳定性:X>Z
C.Z、W均可与Mg形成离子化合物
D.最高价氧化物对应水化物的酸性:Y>W
查看答案和解析>>
科目:高中化学 来源: 题型:
“嫦娥一号”探月卫星的成功发射,标志着我国的空间探究已进入一个新的阶段。“嫦娥一号”的研制,应用了许多尖端的合成高分子材料。高分子材料与一般金属材料相比,其优越性是 ( )。
①强度大 ②溶解性好 ③电绝缘性能好 ④不耐热
⑤耐化学腐蚀
A.①②③ B.①③⑤
C.①②③④⑤ D.②③④
查看答案和解析>>
科目:高中化学 来源: 题型:
金属氢氧化物在酸中溶解度不同,因此可以利用这一性质,控制溶液的pH,达到分离金属离子的目的。难溶金属的氢氧化物在不同pH下的溶解度(S/mol·L-1)如下图所示。
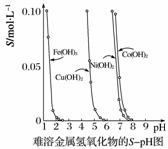
(1)pH=3时溶液中铜元素的主要存在形式是________(写化学式)。
(2)若要除去CuCl2溶液中的少量Fe3+,应该控制溶液的pH为______(填字母)。
A.<1 B.4左右 C.>6
(3)在Ni(NO3)2溶液中含有少量的Co2+杂质,______(填“能”或“不能”)通过调节溶液pH的方法来除去,理由是______________________________________________。
(4)已知一些难溶物的溶度积常数如下表:
| 物质 | FeS | MnS | CuS | PbS | HgS | ZnS |
| Ksp | 6.3×10-18 | 2.5×10-13 | 1.3×10-36 | 3.4×10-28 | 6.4×10-53 | 1.6×10-24 |
某工业废水中含有Cu2+、Pb2+、Hg2+,最适宜向此工业废水中加入过量的________除去它们(填字母)。
A.NaOH B.FeS C.Na2S
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com