
| A、100 mL 0.5 mol?L-1的MgCl2溶液 |
| B、200 mL 0.25 mol?L-1的CaCl2溶液 |
| C、100 mL 1.0 mol?L-1的NaCl溶液 |
| D、200 mL 0.25 mol?L-1的HCl溶液 |


科目:高中化学 来源: 题型:
| A、2HI(g)═H2(g)+I2(g)△H=+11kJ/mol | ||||
B、
| ||||
| C、H2(g)+I2(g)═2HI(g)△H=+288kJ/mol | ||||
D、
|
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、BaSO4?Ba2++SO42- |
| B、H3PO4?3H++PO43- |
| C、Al(OH)3?H++AlO2-+H2O |
| D、NaHS=Na++H++S2- |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、苯酚能与NaOH溶液反应,而乙醇不行 |
| B、甲苯能使酸性高锰酸钾溶液褪色而甲烷不能 |
| C、苯与液溴在铁作催化剂下发生反应,而苯酚与浓溴水混合就能发生反应 |
| D、乙烯可发生加成反应,而乙烷不能 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、42He原子核内含有 4个质子 |
| B、32He和42He互为同位素 |
| C、32He原子核内含有3个中子 |
| D、42He的最外层电子数为2,所以He很容易失去电子,具有较强的金属性 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 3 |
| 5 |
| A、0.74 mol/L |
| B、0.045 m ol/L |
| C、0.037 mol/L |
| D、0.025 mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、2Fe3++SO2+2H2O═2Fe2++SO42-+4H+ |
| B、I2+SO2+2H2O═H2SO4+2HI |
| C、H2O2+H2SO4═SO2↑+O2↑+2H2O |
| D、2Fe3++2I-═2Fe2++I2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、1mol氯约含有6.02×1023个微粒 |
| B、阿佛加德罗常数的数值约等于6.02×1023 |
| C、钠的摩尔质量在数值上一定等于钠的相对原子质量 |
| D、气体摩尔体积是指单位物质的量的物质所占的体积 |
查看答案和解析>>
科目:高中化学 来源: 题型:
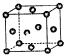 已知:X、Y、Z为短周期元素,X、Y同周期,X和Z同主族,Y原子基态时的2p轨道上未成对的电子数最多,X的低价氧化物和Y单质分子的电子数相等.W2+的核外电子排布简式为:1S22S22P63S23P63d9.
已知:X、Y、Z为短周期元素,X、Y同周期,X和Z同主族,Y原子基态时的2p轨道上未成对的电子数最多,X的低价氧化物和Y单质分子的电子数相等.W2+的核外电子排布简式为:1S22S22P63S23P63d9.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com