
【题目】常温下,二氯化二硫(S2Cl2)为橙黄色液体,遇水易水解,工业上用于橡胶的硫化。某学习小组用氯气和硫单质合成S2Cl2的实验装置如图所示.下列说法正确的是

A. 实验时需先点燃E处的酒精灯
B. C、D中所盛试剂为饱和氯化钠溶液、浓硫酸
C. 二氯化二硫(S2Cl2)水解反应产物为:S、H2S、HCl
D. G中可收集到纯净的产品
 口算与应用题卡系列答案
口算与应用题卡系列答案 名师点睛字词句段篇系列答案
名师点睛字词句段篇系列答案科目:高中化学 来源: 题型:
【题目】合理的利用吸收工业产生的废气CO2、NO2、SO2 等可以减少污染,变废为宝。
(1)用CO2可以生产燃料甲醇。
已知:CO2(g)+3H2(g)═CH3OH(g)+H2O(l)△H=﹣akJmol﹣1;
2H2(g)+O2(g)═2H2O(l)△H=﹣b kJmol﹣1;
则表示CH3OH(g)燃烧的热化学方程式为:_______________________。
(2)光气(COCl2)是重要化工原料,常用于聚酯类材料的生产,工业通过Cl2(g)+CO(g)COCl2(g)△H < 0制备。图为实验研究过程中容器内各物质的浓度随时间变化的曲线。回答下列问题:

①0~6min内,反应的平均速率v(Cl2)=___________;
②该反应第一次达平衡时的平衡常数为___________,10min改变的条件是_____________。
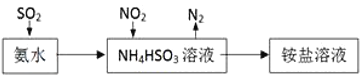
(3)利用氨水可以将SO2和NO2吸收,原理如图所示:NO2被吸收的离子方程式是________________________________。
(4)对于2NO(g)+2CO(g)![]() N2(g)+2CO2(g),于1 L的恒容密闭容器中进行反应。下列能说明该反应已经达到平衡状态的是________(填字母代号)。
N2(g)+2CO2(g),于1 L的恒容密闭容器中进行反应。下列能说明该反应已经达到平衡状态的是________(填字母代号)。
A.c(CO)=c(CO2) B.容器中混合气体的密度不变
C.2v(N2)正=v(NO)逆 D.容器中混合气体的平均摩尔质量不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关物质用途的说法不正确的是
A. 明矾可用作净水剂
B. 热的纯碱溶液可以去除物品表面的油污
C. 氢氧化钠可用来治疗胃酸过多
D. 过氧化钠可用作潜艇里氧气的来源
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在难溶电解质AB2的饱和溶液中,c(A2+)=x mol/L,c(B-)=y mol/L,则Ksp(AB2)为( )
A. xy2 B. xy C. 1/2xy D. 4xy2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室需要0.80 mol·L-1 NaOH溶液 475 mL和0.40 mol·L-1硫酸500 mL。根据这两种溶液的配制情况回答下列问题:
(1)如图所示的仪器中配制溶液肯定不需要的是_______(填序号),配制上述溶液还需用到的玻璃仪器是__________________(填仪器名称)。

(2)根据计算用托盘天平称取NaOH的质量为______g。其他操作均正确,实验中若还未等溶液冷却就定容了,则所得溶液浓度______0.80 mol·L-1。(填“大于”“等于”或“小于”)
(3)试通过计算,所需质量分数为98%、密度为1.84 g·cm-3的浓硫酸的体积为________mL(计算结果保留一位小数)。
(4)准确称量二水合草酸晶体(H2C2O4·2H2O)m g于锥形瓶中,加适量蒸馏水溶解,滴加2滴______指示剂,用未知浓度的NaOH溶液滴定到终点,终点的颜色变化是______;写出滴定反应的离子方程式:______。通过这种滴定方法,可以准确标定出NaOH溶液的浓度,假设消耗NaOH溶液的体积为VmL,列出计算NaOH准确浓度的式子:____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】云阳龙缸云端廊桥曾被詟为“世界第一悬挑玻璃景观廊桥”,所用钢化玻璃因其优良的性能广泛应用于日常生活,但由于制作玻璃时里面含有极少量硫化镍,使得钢化玻璃在极限条件下的使用受到限制.
(1)基态硫原子价层电子的轨道表达式(电子排布图)为____________,基态镍原子中核外电子占据最高能层的符号为_____________.
(2)Ni(CO)4常用于制备纯镍,溶于乙醇、CCl4、苯等有机溶剂,为___________晶体,Ni(CO)4空间构型与甲烷相同,中心原子的杂化轨道类型为___________,写出与配体互为等电子体的阴离子__________________________________________________________(任写一种).
(3)与硫同族的硒元素有两种常见的二元含氧酸,请比较它们酸性强弱 > (填化学式)______,理由是_______________________________________________________________.
(4)H2S的键角__________(填“大于”“小于””等于”)H2O的键角,请从电负性的角度说明理由___________________________________________________.
(5)NiO与NaCl的晶胞结构相似,如图所示,阴离子采取面心立方堆积,阳离子填充在位于阴离子构成的空隙中,已知Ni2+半径为69nm,O2-半径为140nm,阿伏伽德罗常数为NA,NiO晶体的密度为_________g/cm3(只列出计算式).

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在化学研究领域,经常需要对一些物质进行性质的确定。如利用下列装置(夹持仪器已略去)测出一定质量镁与盐酸反应放出的气体体积,对金属镁的相对原子质量进行测定,实验步骤如下:
①准确称量m g金属镁(已除去表面氧化膜),用铜网包住放入干净的试管中;
②按图示组装好装置,然后在关闭活塞的分液漏斗中装入一定体积2 mol/L的盐酸;
③调整右边玻璃管(带均匀刻度值),让U型管(下端黑色部分是橡胶管)两端液面在同一水平面,读出右边玻璃管的液面刻度值为V1mL ;
④打开分液漏斗活塞,让一定量的盐酸进入试管中后立即关闭活塞;
⑤当镁条反应完后, ,读出右边玻璃管的液面刻 度为V2 mL。

请回答下列问题:
(1)写出你认为步骤⑤中空格应进行的操作_______________________________。
(2)若V1,V2均是折算为标况下的值,则镁的相对原子质量Ar(Mg)的实验测定表达式为Ar(Mg)=_______________,你认为此表达式求出的值是否准确?__________________(填‘是’或‘不’),主要问题为__________________________________(若回答‘是’则此空不填)。
(3)步骤①中,为什么要用铜网包住镁条?________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com