
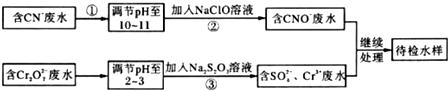
分析 (1)步骤②中,CN-被ClO-氧化为CNO-,则因为是在碱性环境中,故ClO-只能被还原为Cl-,结合电荷守恒和原子守恒书写离子方程式;
(2)根据0.4 mol Cr2O72-等转化为Cr3+即可计算出转移电子的物质的量;
(3)加入熟石灰进一步处理,调节废水pH,使其转化成Cr(OH)3沉淀除去;
(4)反应后测得溶液pH=7,则可推知NaCN过量,根据电荷守恒和物料守恒即可计算出CN-和HCN的浓度,进而计算出Ka﹦(100a-1)×10-7 mol•L-1;
a、溶液中存在电荷守恒,阴阳离子电荷总数相同,电性相反;
b、溶液中存在物料守恒,浓度均为0.1mol•L-1的NaCN、HCN溶液等体积混合后,溶液中钠离子物质的量的2倍等于HCN和CN-物质的量总和;
c、混合后得溶液中c(HCN)=0.05 mol•L-1,c(NaCN)=0.05 mol•L-1,溶液呈碱性,说明NaCN水解程度大于HCN的电离程度,水解促进水的电离;
d、溶液混合后形成的是缓冲溶液,加入少量酸或碱,溶液酸碱性变化不大;
(5)待检水样中还有Cu2+,加碱发生Cu2++2OH-═Cu(OH)2↓,再加入Na2S溶液,CuS比Cu(OH)2更难溶,则发生Cu(OH)2(s)+S2-(aq)═CuS(s)+2OH-(aq).
解答 解:(1)碱性条件下,CN-离子与NaClO发生氧化还原反应生成CNO-、Cl-离子,离子反应为:CN-+ClO-═CNO-+Cl-;
故答案为:CN-+ClO-═CNO-+Cl-;
(2)根据0.4 mol Cr2O72-等转化为Cr3+,铬元素化合价降低3价,0.4molCr2O72-共得到了0.4×(2×3)mol=2.4mol;
故答案为:2.4;
(3)含Cr3+废水可以加入熟石灰进一步处理,目的是调节废水pH,使其转化成Cr(OH)3沉淀除去;
故答案为:调节废水pH,使其转化成Cr(OH)3沉淀除去;
(4)由于反应后测得溶液pH=7,当a=0.01时,恰好反应,生成了氰化氢溶液,溶液显示酸性,故氰化钠应该多些,故a>0.01; 根据电荷守恒:c(Na+)+c(H+)=c(OH-)+c(CN-)+c(Cl-),PH=7,c(H+)=c(OH-),c(CN-)=c(Na+)-c(Cl-)=$\frac{a}{2}$mol/L-$\frac{0.01}{2}$mol/L;
再根据物料守恒:c(CN-)+c(HCN)=c(Na+)=$\frac{a}{2}$mol/L;Ka﹦$\frac{c({H}^{+})c(C{N}^{-})}{c(HCN)}$=$\frac{(\frac{a}{2}mol/L-\frac{0.01}{2}mol/L)×1{0}^{-7}mol/L}{\frac{0.01}{2}mol/L}$=a(100a-1)×10-7 mol•L-1;
若25℃时将浓度均为0.1mol•L-1的NaCN、HCN溶液等体积混合后,混合后得溶液中c(HCN)=0.05 mol•L-1,c(NaCN)=0.05 mol•L-1,溶液呈碱性,说明NaCN水解程度大于HCN的电离程度;
a、据电荷守恒可知c(H+)+c(Na+)=c(CN-)+c(OH-),此溶液一定有c(Na+)+c(H+)=c(OH-)+c(CN-),故a正确;
b.由物料守恒可知c(HCN)+c(CN-)=0.1mol•L-1,所以c(HCN)+c(CN-)=2c(Na+),故b错误;
c.若25℃时将浓度均为0.1mol•L-1的NaCN、HCN溶液等体积混合后,混合后得溶液中c(HCN)=0.05 mol•L-1,c(NaCN)=0.05 mol•L-1,溶液呈碱性,说明NaCN水解程度大于HCN的电离程度,混合溶液中水的电离程度一定大于该温度下纯水的电离程度,故c正确;
d.若25℃时将浓度均为0.1mol•L-1的NaCN、HCN溶液等体积混合后形成缓冲溶液,此溶液加入少量氢氧化钠抑制水解,促进电离,加入盐酸抑制电离促进水解,溶液酸碱性变化不大,所以溶液的pH变化不大,故d正确;
故答案为:(100a-1)×10-7 mol•L-1 ;b;
(5)蓝色沉淀为Cu(OH)2,CuS(s)比Cu(OH)2(s)更难溶,发生了沉淀的转化.反应方程式为:Cu2++2OH-═Cu(OH)2↓;Cu(OH)2(s)+S2-(aq)═CuS(s)+2OH-(aq),
故答案为:Cu2++2OH-═Cu(OH)2↓;Cu(OH)2(s)+S2-(aq)═CuS(s)+2OH-(aq).
点评 本题以工艺流程为载体,侧重化学基本概念、基本理论,考查了氧化还原反应及离子方程式的书写,水溶液中的离子平衡、离子浓度、电离常数、沉淀溶解平衡等电解质溶液的相关知识.考查学生的知识运用能力、灵活分析处理实际问题的能力,题目难度中等.


 夺冠金卷全能练考系列答案
夺冠金卷全能练考系列答案科目:高中化学 来源: 题型:解答题
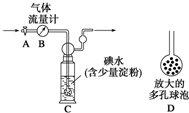 硫酸工业尾气中二氧化硫的含量超过0.05%(体积分数)时需经处理后才能排放.某校兴趣小组欲测定硫酸工业尾气中二氧化硫的含量,采用以下方案:
硫酸工业尾气中二氧化硫的含量超过0.05%(体积分数)时需经处理后才能排放.某校兴趣小组欲测定硫酸工业尾气中二氧化硫的含量,采用以下方案:查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 它只有一种氧化物Cs2O | B. | 它与水剧烈反应 | ||
| C. | Cs+具有很强的氧化性 | D. | CsHCO3受热不易分解 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题


查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 取溴代烃少许,加入AgNO3溶液 | |
| B. | 取溴代烃少许与NaOH水溶液共热,然后加入AgNO3溶液 | |
| C. | 取溴代烃少许与NaOH乙醇溶液共热后,加入稀硝酸酸化后,再加入AgNO3溶液 | |
| D. | 取溴代烃少许与NaOH水溶液共热后,加入稀硝酸酸化后,再加入AgNO3溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 单质的颜色随核电荷数的增加逐渐加深 | |
| B. | 氢化物的稳定性随核电荷数的增加逐渐减弱 | |
| C. | 单质与水反应均可表示为X+H2O=HX+HXO | |
| D. | 随核电荷数的增加卤素原子的半径递增,卤素离子的还原性增强 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com