
| A. | Na能与CuSO4溶液反应置换出红色的铜 | |
| B. | Na2O是碱性氧化物,与酸反应生成盐和水 | |
| C. | Na2O和Na2O2都能与水反应,生成物完全相同 | |
| D. | Na2O2是白色固体,可用于呼吸面具中氧气的来源 |
分析 A、硫酸铜溶液和钠反应,可看作钠先和水反应,然后生成的氢氧化钠再和硫酸铜反应,所以产物有蓝色沉淀、气体、硫酸钠;
B、碱性氧化物与酸反应生成盐与水,如氧化钠与盐酸反应生成氯化钠和水;
C、Na2O与水反应,生成氢氧化钠,而Na2O2与水反应,生成氢氧化钠与氧气;
D、Na2O2是淡黄色的固体.
解答 解:A、硫酸铜溶液和钠反应,可看作钠先和水反应,然后生成的氢氧化钠再和硫酸铜反应,所以产物有蓝色沉淀、气体、硫酸钠,没有铜生成,不是发生置换反应,故A错误;
B、碱性氧化物与酸反应生成盐与水,如氧化钠与盐酸反应生成氯化钠和水,所以氧化钠是碱性氧化物,故B正确;
C、Na2O与水反应,生成氢氧化钠,而Na2O2与水反应,生成氢氧化钠与氧气,则两者与水反应的产物不同,故C错误;
D、Na2O2是淡黄色的固体,而不是白色固体,故D错误;
故选B.
点评 本题考查钠及其化合物的性质,为高频考点,侧重考查学生对基础知识的掌握,明确元素化合物性质及基本概念内涵是解本题关键,比较容易.


科目:高中化学 来源: 题型:选择题
| A. | Z的浓度可能为0.3mol/L | |
| B. | 平衡时X2、Y2的转化率相等 | |
| C. | 平衡时,Y2和Z的生成速率之比为2:1 | |
| D. | 若平衡后再改变外界条件,升高温度,则反应的平衡常数将变大 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 已知某“84消毒液”瓶体部分标签如图所示,该“84消毒液”通常稀释100倍(体积之比)后使用.
已知某“84消毒液”瓶体部分标签如图所示,该“84消毒液”通常稀释100倍(体积之比)后使用.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | .硅酸三钙 | B. | .碳酸二钙 | C. | 铝酸三钙 | D. | .碳酸钙 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①② | B. | ②④ | C. | ③④ | D. | ①③ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1,2-二溴乙烷和1,1-二氯丙烷 | B. | 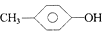 和 和 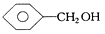 | ||
| C. | 苯 和 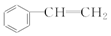 | D. | 丙炔 和 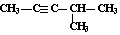 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 4L、0.5mol/L NaCl溶液 | B. | 1L、0.3mol/L Na2SO4溶液 | ||
| C. | 5L、0.4 mol/L NaOH溶液 | D. | 2L、0.15 mol/L、Na3PO4溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com