
| A. | NaOH(aq)+HCl(aq)═NaCl(aq)+H2O(l);△H=+28.7 kJ•mol-1 | |
| B. | NaOH(aq)+HCl(aq)═NaCl(aq)+H2O(l);△H=-28.7 kJ•mol-1 | |
| C. | NaOH(aq)+HCl(aq)═NaCl(aq)+H2O(l);△H=+57.4 kJ•mol-1 | |
| D. | NaOH(aq)+HCl(aq)═NaCl(aq)+H2O(l);△H=-57.4 kJ•mol-1 |
分析 根据n=$\frac{m}{M}$计算,含NaOH 20.0g的稀溶液中含有0.5mol氢氧化钠,与足量稀盐酸反应放出28.7kJ的热量,热化学方程式标注物质的聚集状态和对应反应焓变,焓变与化学计量数成正比,则该热化学方程式为:NaOH(aq)+HCl(aq)=NaCl(aq)+H2O(l);△H=-57.4kJ•mol-1,
A.酸碱反应是放热反应;
B.焓变是对应化学方程式计量数条件下的反应热效应;
C.酸碱反应是放热反应;
D.依据化学方程式计量数计算反应的焓变.
解答 解:A.酸碱中和反应是放热反应,故A错误;
B.含NaOH 20.0g的稀溶液与足量的稀盐酸反应,放出28.7kJ的热量,反应的热化学方程式为:NaOH(aq)+HCl(aq)=NaCl(aq)+H2O(l)△H=-57.4kJ/mol,故B错误;
C.酸碱中和反应是放热反应,故C错误;
D.含NaOH 20.0g的稀溶液中含有n=$\frac{m}{M}$=$\frac{20g}{40g/mol}$=0.5mol,与足量的稀盐酸反应,放出28.7kJ的热量,反应的热化学方程式为:NaOH(aq)+HCl(aq)=NaCl(aq)+H2O(l)△H=-57.4kJ/mol,故D正确;
故选D.
点评 本题考查热化学方程式的书写方法和注意问题,关键是对应化学方程式计量数条件下的焓变计算,题目较简单.


 百年学典课时学练测系列答案
百年学典课时学练测系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | H2O2分子中只存在极性键 | B. | NH3的结构式为 | ||
| C. | HCl的电子式为  | D. | H2O中含有离子键 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
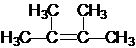 ;
; .
. .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 碳酸氢钠的水解方程式:HCO3-+H2O=CO32-+H3O+ | |
| B. | 在稀溶液中,酸跟碱反应生成1mol水时放出57.3KJ的热量,则稀盐酸与澄清石灰水发生中和反应的热化学方程式为H+(aq)+OH-(aq)═H2O(l)△H=-57.3kJ•mol-1 | |
| C. | 向NaHSO4溶液中加入过量Ba(OH)2溶液的离子方程式:2H++SO42-+Ba2++2OH-═BaSO4↓+2H2O | |
| D. | 用Na2CO3溶液吸收少量SO2的离子方程式:CO32-+SO2═CO2+SO32- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
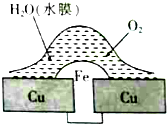
| A. | 此过程中铜被腐蚀 | |
| B. | 此过程中电子从Cu移向Fe | |
| C. | 铁铆钉表面发生的电极反应为Fe-3e-═Fe3+ | |
| D. | 在金属表面刷上一层油漆,能延缓铁铆钉的腐蚀 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | NO(NO2)--通入足量水中,再用向上排空气法收集气体 | |
| B. | NaHCO3溶液(Na2CO3)--通入过量CO2 | |
| C. | Cl2(HCl)--用排饱和NaCl溶液的方法收集气体 | |
| D. | CuO(C)--直接在空气中加热 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②⑦ | B. | ①②③⑥ | C. | ①②⑥ | D. | ①②③⑥⑦ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 此电池的正极为Ni2O3,电池中的凝胶呈弱酸性 | |
| B. | 放电时,负极反应式为Al+3H2O-3e-═Al(OH)3+3H+ | |
| C. | 电池充电过程中,阳极附近溶液的pH升高 | |
| D. | 充电时,外接直流电源负极与铝镍胶体电池铝电极相连 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com