
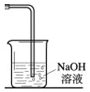
 ʵ���ҳ������·�����ȡ������MnO2+4HCl��Ũ�� $\frac{\underline{\;\;��\;\;}}{\;}$ MnCl2+Cl2��+2H2O��������һ����Ҫ�Ļ���ԭ�ϣ��ڹ�ũҵ������������������Ҫ��Ӧ�ã����������ѧ֪ʶ�ش�
ʵ���ҳ������·�����ȡ������MnO2+4HCl��Ũ�� $\frac{\underline{\;\;��\;\;}}{\;}$ MnCl2+Cl2��+2H2O��������һ����Ҫ�Ļ���ԭ�ϣ��ڹ�ũҵ������������������Ҫ��Ӧ�ã����������ѧ֪ʶ�ش����� ��1����������ˮ��������ˮ��Ӧ��������ʹ����ᣬ����������ԣ����������Ư���ԣ�����������Һ�ȱ�죬���������Ư������Һ��ɫ��
��
��2������MnO2+4HCl��Ũ�� $\frac{\underline{\;\;��\;\;}}{\;}$ MnCl2+Cl2��+2H2O���㣻
��3�������������������Ʒ�Ӧ�ķ���ʽ��������������Ƶ������
��� �⣺��1����������ˮ��������ˮ��Ӧ��������ʹ����ᣬ����������ԣ����������Ư���ԣ���ѧ����ʽ��Cl2+H2O?HCl+HClO������������Һ�ȱ�죬���������Ư������Һ����ɫ�����Կ�����Һ�ȱ�����ɫ��
�ʴ�Ϊ����Һ�ȱ�����ɫ��Cl2+H2O?HCl+HClO������������Һ�ȱ�죬���������Ư������Һ��ɫ��
��2����ΪMnO2+4HCl��Ũ�� $\frac{\underline{\;\;��\;\;}}{\;}$ MnCl2+Cl2��+2H2O����μӷ�Ӧ��MnO2������Ϊxg
87g 22.4L
xg 11.2L
����x=$\frac{87g��11.2L}{22.4L}$=43.5g���𣺲μӷ�Ӧ��MnO2������Ϊ43.5g��
��3��4����ʱn��Cl2��=$\frac{1.12L}{22.4L/mol}$��4=0.2mol�����ݷ�Ӧ����ʽCl2+2HaOH=NaCl+NaClO+H2O��֪����Ҫn��NaOH��=0.4mol������V��NaOH��=$\frac{0.4mol}{2mol/L}$=0.2L=200mL��
��NaOH��Һ���������ӦΪ200mL��
���� ����ͨ����HClO��Ư���Ե�̽��������ѧ���������֪ʶ�����������ܵĻ�ѧ��˼ά��������ػ���������������Ŀ�Ѷ���Ȼ����Ҳ����һ�����ۺ��ԣ��ڴ���ʱҪע��淶�����Ա��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
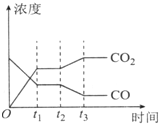 ���ܼ����ǵ��»����������ص㣮
���ܼ����ǵ��»����������ص㣮| H2O | CO | C02 | H2 | |
| n/mol | 0.20 | 0.20 | 0 | 0 |
| ������� | c��CO��/mol•L-1 | c��02��/mol•L-1 | c��C02��/mol•L-1 | V��������v���棩�Ƚ� |
| �� | 2.0��10-4 | 4.0��10-4 | 4.0��10-2 | V������=v���� |
| �� | 3.0��10-4 | 4.0��10-4 | 5.0��10-2 | V�������� v���� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ʵ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
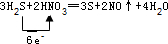 ��
���鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
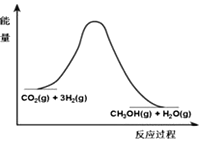 ��������ЧӦ����Դ��ȱ�����⣬��ν��ʹ����е�CO2���������Կ������ã������˸�����ձ����ӣ�Ŀǰ��ҵ����һ�ַ�������CO2����ȼ�ϼ״���һ�������·�����Ӧ��CO2��g��+3H2��g��?CH3OH��g��+H2O��g�����÷�Ӧ�������仯��ͼ��ʾ��
��������ЧӦ����Դ��ȱ�����⣬��ν��ʹ����е�CO2���������Կ������ã������˸�����ձ����ӣ�Ŀǰ��ҵ����һ�ַ�������CO2����ȼ�ϼ״���һ�������·�����Ӧ��CO2��g��+3H2��g��?CH3OH��g��+H2O��g�����÷�Ӧ�������仯��ͼ��ʾ��| t/min | 0 | 2 | 5 | 10 | 15 |
| n��CO2��/mol | 1 | 0.75 | 0.5 | 0.25 | 0.25 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ʵ����
| ������ | K+��Al3+��Mg2+��Ba2+ Fe3+ |
| ������ | NO3-��CO32-��SiO32-��SO42- OH- |
| ��� | ʵ������ | ʵ���� |
| �� | �����Һ�м�������ϡ���� | ������ɫ�������ų���״����1.12L���� |
| �� | ����ķ�Ӧ���Һ���ˣ��Գ���ϴ�ӡ����������أ��������ù������� | ��������Ϊ4.8g |
| �� | ������Һ�еμ�BaCl2��Һ | ���������� |
| ������ | Ũ��c/��mol•L-1�� |
| ��CO32- | 0.5mol/L |
| ��SiO32- | 0.8mol/L |
| �� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ʳ�Ρ���ˮ | B�� | �ȡ��塢�� | C�� | �ơ�þ | D�� | �ռ���� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ������ɫ����������ζ��Һ�� | |
| B�� | �����±���һ�ֲ�����ˮ���ܶ�С��ˮ��Һ�� | |
| C�� | ����һ�������������巢��ȡ����Ӧ | |
| D�� | �������е��͵�˫����Ӧ���еķ����ӳɷ�Ӧ�����ԣ��ʲ����ܷ����ӳɷ�Ӧ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com