
分析 (1)气缸内,氮气和氧气在高温、高压下反应生成一氧化氮;
(2)结合各种尾气、废气、废水的主要成分及危害分析;
(3)要提高尾气处理效果,需要尾气排放到大气之前尽可能的转化为无害气体,应从速率及平衡的角度分析:
①催化剂,可以加快反应速率,但不影响转化率;
②提高温度,能加快反应速率,但会降低转化率;
③降低压强,既减慢反应速率,又降低转化率;
④放入碱石灰,可以吸收生成的二氧化碳,使平衡向右移动;
(4)有毒或有刺激性气味的物质、固体颗粒物都对环境造成污染;
(5)根据“绿色汽车”的概念来判断;
(6)天然气(主要成分CH4)、液化石油气(C3~C5的烃)其成分均为碳氢化合物.
解答 解:(1)汽车在工作时发动机的活塞在气缸中运行一个循环时要经过进气、压缩、点火燃烧和排气四个过程,所以又叫四冲程内燃机.在压缩和点火燃烧等过程中由于产生高压高温,空气中N2和O2发生如下反应:N2+O2$\frac{\underline{\;放电\;}}{\;}$2NO,2NO+O2═2NO2,生成污染大气的NO、NO2,
故选D;
(2)氮氧化物是形成光化学烟雾的成分,二氧化硫和氮氧化物是形成酸雨的成分,工业废水是形成公害病的物质,故选A;
(3)①选用适当的催化剂,可以加快反应速率,但不影响转化率,使有害气体在排出之前尽可能地转化为无害气体,可以提高尾气处理效果,故正确;
②提高装置温度,虽然能加快反应速率,但会降低转化率,故不正确;
③降低装置的压强,既减慢反应速率,又降低转化率,故不正确;
④装置中放入碱石灰,可以吸收生成的二氧化碳,使平衡向右移动,提高转化率,故正确.
故答案为:C;
(4)有毒或有刺激性气味的物质、固体颗粒物都对环境造成污染,
A.CO2和H2均不属于有害气体,故A选;
B.NO2和NO都是有毒气体,属于有害气体,故B不选;
C.CO和SO2都是有毒气体,属于有害气体,故C不选;
D.碳粒和含铅化合物都是对环境有污染的物质,故D不选;
故选A;
(5)“绿色汽车”是指使用液化石油气作能源的汽车.绿色汽车可避免有毒的铅、苯的同系物以及稠环芳烃的排放.燃烧等质量的液化石油气(主要成分是含C3~C5的烃)与汽油相比较前者产生的含碳化合物少,故选D;
(6)天然气(主要成分CH4)、液化石油气(C3~C5的烃)其成分中只含C、H元素,所以均为碳氢化合物,完全燃烧的产物为CO2和H2O,不会造成环境污染,但生成的CO2却是造成温室效应的元凶,故选B.
点评 本题考查了生活环境与污染,明确物质的性质是解本题关键,运用化学知识解释生产生活现象,难度不大.


科目:高中化学 来源: 题型:选择题
| A. | +1 | B. | +2 | C. | +3 | D. | +4 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | FeO与稀硝酸反应:FeO+2H+═Fe2++H2O | |
| B. | (NH4)2Fe(SO4)2溶液与过量NaOH溶液反应:Fe2++2OH-═Fe(OH)2↓ | |
| C. | 溴化亚铁溶液中通入足量氯气:2Fe2++4Br-+3Cl2═2Fe3++2 Br2+6Cl- | |
| D. | 向FeCl3溶液中加入Mg(OH)2:3Mg(OH)2+2Fe3+═2Fe(OH)3+3Mg2+ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 PET是聚酯类合成材料,以卤代烃为原料合成PET的线路如图(反应中部分无机反应物及产物已省略).已知RX2(R、R′代表烃基,X代表卤素原子)是芳香族化合物,相对分子质量为175,其中X元素的质量分数为40.6%.
PET是聚酯类合成材料,以卤代烃为原料合成PET的线路如图(反应中部分无机反应物及产物已省略).已知RX2(R、R′代表烃基,X代表卤素原子)是芳香族化合物,相对分子质量为175,其中X元素的质量分数为40.6%. .
. +nHOCH2CH2OH$\stackrel{一定条件下}{→}$
+nHOCH2CH2OH$\stackrel{一定条件下}{→}$ +2nH2O.
+2nH2O.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
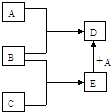 已知A、B、C、D、E均为中学化学中常见物质,在一定条件下相互转化关系如下图所示(反应条件和部分产物已省略).已知:
已知A、B、C、D、E均为中学化学中常见物质,在一定条件下相互转化关系如下图所示(反应条件和部分产物已省略).已知:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 某温度下的溶液中,c (H+)=10x mol/L,c (OH-)=10y mol/L.
某温度下的溶液中,c (H+)=10x mol/L,c (OH-)=10y mol/L.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 时间(h) | 1 | 2 | 3 | 4 | 5 | 6 |
| P后/P前 | 0.90 | 0.85 | 0.82 | 0.81 | 0.80 | 0.80 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ③④⑤ | B. | ②③④⑤ | C. | ②⑤⑥⑦ | D. | ①②③④⑤ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com