
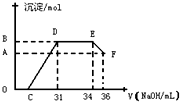
 Ⅰ将a mol的Na2O2和bmol NaHCO3固体混合后,在密闭容器中加热到250℃,让其充分反应,假设NaHCO3分解产生的CO2与Na2O2反应完后,H2O再与Na2O2反应.
Ⅰ将a mol的Na2O2和bmol NaHCO3固体混合后,在密闭容器中加热到250℃,让其充分反应,假设NaHCO3分解产生的CO2与Na2O2反应完后,H2O再与Na2O2反应.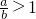 时,剩余固体是______,排出气体是______.
时,剩余固体是______,排出气体是______.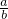 的值为______.
的值为______.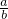 的值为______.
的值为______. 2Na2CO3+H2O+
2Na2CO3+H2O+ O2,所以排出气体中O2的物质的量是过氧化钠的一半为
O2,所以排出气体中O2的物质的量是过氧化钠的一半为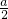 mol,故答案为:
mol,故答案为: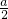 mol;
mol;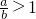 时,发生的化学反应为2NaHCO3+2Na2O2
时,发生的化学反应为2NaHCO3+2Na2O2 2Na2CO3+2NaOH+O2,过氧化钠有剩余,碳酸氢钠分解生成的二氧化碳和水完全反应,固体中含有Na2CO3、NaOH、Na2O2,排出气体为O2,故答案为:Na2CO3、NaOH、Na2O2;排出气体为O2;
2Na2CO3+2NaOH+O2,过氧化钠有剩余,碳酸氢钠分解生成的二氧化碳和水完全反应,固体中含有Na2CO3、NaOH、Na2O2,排出气体为O2,故答案为:Na2CO3、NaOH、Na2O2;排出气体为O2;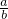 的值为
的值为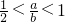 ,故答案为:
,故答案为: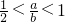 ;
; Na2CO3+H2O+CO2 ①
Na2CO3+H2O+CO2 ①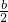
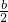
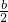
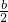
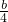
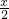
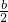 -x,氧气的量为
-x,氧气的量为 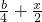 ,当排出的O2和H2O为等物质的量时,则
,当排出的O2和H2O为等物质的量时,则 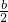 -x=
-x=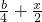 ,x=
,x=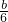 ,所以a=
,所以a=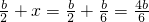 ,所以
,所以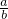 =
=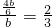 ,故答案为:
,故答案为: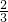 ;
; 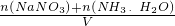 =
=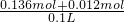 =1.48mol/L,故答案为:1.48;
=1.48mol/L,故答案为:1.48;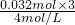 ×103ml/L=7mL.
×103ml/L=7mL. Na2CO3+H2O+CO2 ①
Na2CO3+H2O+CO2 ①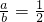 ;若Na2O2不足,则CO2有剩余,则
;若Na2O2不足,则CO2有剩余,则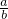 <
< .
.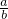 =1,有Na2CO3、NaOH和O2;若Na2O2不足以与水完全反应,则水蒸气有剩余,
=1,有Na2CO3、NaOH和O2;若Na2O2不足以与水完全反应,则水蒸气有剩余,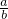 <1;若Na2O2有剩余,则
<1;若Na2O2有剩余,则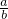 >1.
>1.

科目:高中化学 来源:湖北黄石二中2010届高三年级八月考试化学试题 题型:013
|
将a mol Na和a mol Al一同投入m g足量水中,所得溶液密度为d g·cm-3,该溶液的质量分数为 | |
| [ ] | |
A. |
82a/(46a+m)% |
B. |
82000a/(46a+2m)% |
C. |
8200a/(46a+m)% |
D. |
8200a/(69a+2m)% |
查看答案和解析>>
科目:高中化学 来源:江西省定南中学2010届高三年级八月考试化学试题 题型:013
|
将a mol Na和a mol Al一同投入m g足量水中,所得溶液密度为d g·cm-3,该溶液的质量分数为 | |
| [ ] | |
A. |
82a/(46a+m)% |
B. |
82000a/(46a+2m)% |
C. |
8200a/(46a+m)% |
D. |
8200a/(69a+2m)% |
查看答案和解析>>
科目:高中化学 来源:上海市吴淞中学2011届高三上学期第二次月考化学试题 题型:013
|
将a mol Na和a mol Al一同投入m g足量水中,所得溶液密度为d g·cm-3,该溶液的质量分数为 | |
| [ ] | |
A. |
82a/(46a+m)% |
B. |
82a/(69a+2m)% |
C. |
8200a/(46a+m)% |
D. |
8200a/(69a+2m)% |
查看答案和解析>>
科目:高中化学 来源:辽宁省铁岭高级中学2012届高三第一学期期中考试化学试题 题型:013
|
将a mol Na和a mol Al一同投入m g足量水中,所得溶液密度为dg·cm-3,该溶液的质量分数为 | |
| [ ] | |
A. |
82a/(46a+m)% |
B. |
82a/(69a+2m)% |
C. |
8200a/(46a+m)% |
D. |
8200a/(69a+2m)% |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com