
| A.向碘水中滴加CCl4,振荡静置后分层,CCl4层呈紫红色,说明可用CCl4从碘水中萃取碘 |
| B.向SO2水溶液中滴加盐酸酸化的BaCl2溶液,有白色沉淀生成,说明BaSO4难溶于盐酸 |
| C.向0.1mol·L-1 FeSO4溶液中滴加少量酸性KMnO4溶液,KMnO4溶液褪色,说明Fe2+具有 氧化性 |
| D.向2.0mL浓度均为0.1mol·L-1的KCl、KI混合溶液中滴加1~2滴0.01mol·L-1 AgNO3溶液, |
 三新快车金牌周周练系列答案
三新快车金牌周周练系列答案科目:高中化学 来源:不详 题型:单选题
 2NH3(g) ΔH=-92.4 kJ/mol
2NH3(g) ΔH=-92.4 kJ/mol| A.混合气体的质量不变时,说明该反应一定达到平衡状态 |
| B.将容器的体积扩大到原来的二倍,υ(正)减小,υ(逆)增大,平衡向左移动 |
| C.催化剂既能提高N2的转化率,又能缩短达到平衡所需时间,提高生产效益 |
| D.在密闭容器中放入1 mol N2和3 mol H2进行反应,测得反应放出的热量小于92.4 kJ |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题

查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
 +6HCHO=3H++6H2O+(CH2)6N4H+ [滴定时,1 mol(CH2)6N4H+与 l mol H+相当],然后用NaOH标准溶液滴定反应生成的酸,某兴趣小组用甲醛法进行了如下实验:
+6HCHO=3H++6H2O+(CH2)6N4H+ [滴定时,1 mol(CH2)6N4H+与 l mol H+相当],然后用NaOH标准溶液滴定反应生成的酸,某兴趣小组用甲醛法进行了如下实验:
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
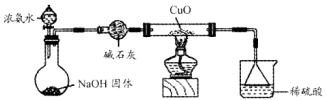
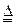 N2+3Cu+3H2O。
N2+3Cu+3H2O。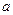 mol气体后,烧杯中的溶液能使酚酞变红。试依据“化学实验设计基本要求”设计制备硫酸亚铁铵溶液的方案,清简述实验方法。
mol气体后,烧杯中的溶液能使酚酞变红。试依据“化学实验设计基本要求”设计制备硫酸亚铁铵溶液的方案,清简述实验方法。 查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.铝粉中混有镁粉:加足量的氢氧化钠溶液,然后过滤即可 |
| B.氯气中混有氯化氢:用饱和食盐水洗气 |
| C.自来水中混有少量Fe3+:采用蒸馏方法 |
| D.固体MnO2中混有KCl:加水,然后过滤 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:问答题

查看答案和解析>>
科目:高中化学 来源:不详 题型:问答题
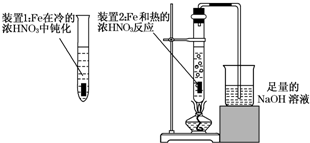
查看答案和解析>>
科目:高中化学 来源:不详 题型:问答题
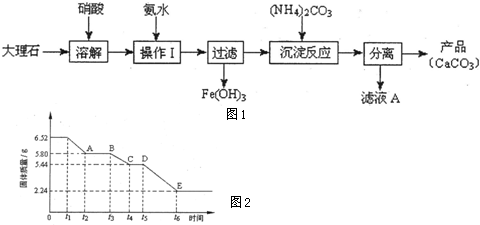
| ||
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com