
| A. | 同族元素,随着核外电子层数的增加,I1逐渐增大 | |
| B. | 通常情况下,对于同一种元素的原子,其电离能I1<I2<I3 | |
| C. | 同周期元素,总体变化趋势是随着核电荷数的增加,I1增大 | |
| D. | 通常情况下,电离能越小,元素的金属性越强 |
分析 同主族元素从上到下,第一电离能逐渐减小,同周期元素从左到右,第一电离能逐渐增大,一般来说,第一电离能越小,对应的单质越活泼,对于同一种元素的原子,其电离能I1<I2<I3,以此解答该题.
解答 解:A.同主族元素自上而下,随电子层增大,元素的第一电离能逐渐减小,故A错误;
B.因为同一原子失去电子的能力越来越难,所以其电离能的大小关系为I1<I2<I3,故B正确;
C.同周期元素的第一电离能呈增大的趋势,注意同周期第ⅡA和第ⅤA族出现反常,故C正确;
D.一般来说,第一电离能越小,在反应中越易失去电子,对应的单质越活泼,故D正确.
故选A.
点评 本题考查同周期、同主族元素性质的递变规律与元素周期律实质,为高频考点,侧重于学生的分析能力的考查,题目比较基础,注意基础知识的掌握.


科目:高中化学 来源: 题型:解答题
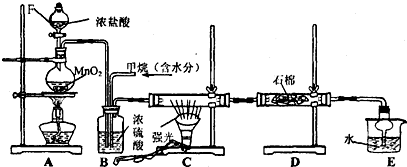
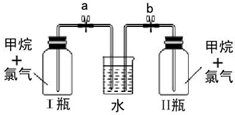
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
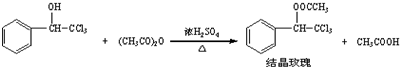
| 三氯甲基苯基甲醇 | 无色液体.不溶于水,溶于乙醇. |
| 醋酸酐 | 无色液体.溶于水形成乙酸,溶于乙醇. |
| 结晶玫瑰 | 白色至微黄色晶体.不溶于水,溶于乙醇.熔点:88℃ |
| 醋酸 | 无色的吸湿性液体,易溶于水、乙醇. |
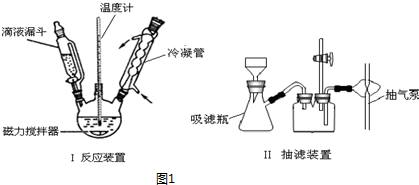
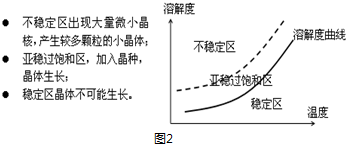
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 元素 | I1 | I2 | I3 | I4 |
| X | 500 | 4600 | 6900 | 9500 |
| Y | 580 | 1820 | 2750 | 11600 |
| A. | 元素X的常见化合价是+3 | |
| B. | 元素Y是ⅢA族元素 | |
| C. | 元素X与氯元素形成化合物时,化学式可能是XCl2 | |
| D. | 若元素Y处于第三周期,它可与冷水剧烈反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 坩埚质量(g) | 坩埚和晶体的总质量(g) | 加热后坩埚和剩余固体的质量(g) |
| 11.685 | 13.691 | 12.948 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 电离能(KJ/mol) | I1 | I2 | I3 | I4 |
| A | 932 | 1821 | 15399 | 21771 |
| B | 738 | 1451 | 7733 | 10540 |
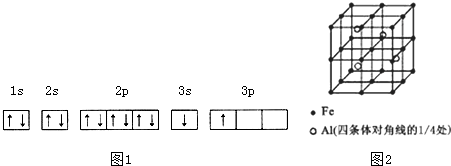
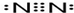 .
.查看答案和解析>>
科目:高中化学 来源: 题型:实验题
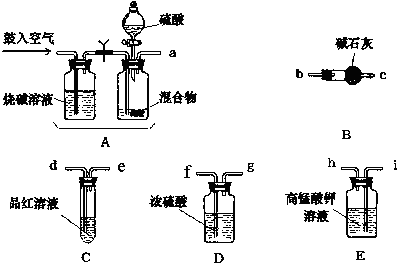
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com