
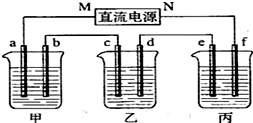
分析 乙为足量的CuSO4溶液,接通电源,经过一段时间后,乙中c电极质量增加,由此可知c为电解池的阴极,则d为阳极,M为负极,N为正极,a为阴极,
b为阳极,e为阴极,f为阳极,电解池工作时,阳极发生氧化反应,阴极发生还原反应,结合电解规律和离子的放电顺序可解答该题.
解答 解:(1)乙杯中c质量增加,说明Cu沉积在c电极上,电子是从b-c移动,M是负极,N为正极;甲中为NaOH,相当于电解H2O,阳极b处为阴离子OH-放电,即4OH--4e-=2H2O+O2↑,故答案为:正;4OH--4e-=2H2O+O2↑;
(2)甲中相当于电解水,故NaOH的浓度增大,pH变大;乙中阴极为Cu2+放电,阳极为OH-放电,电解方程式为:2CuSO4+2H2O$\frac{\underline{\;通电\;}}{\;}$2Cu+O2↑+2H2SO4,所以H+增多,故pH减小;丙中为电解水,对于K2SO4而言,其pH几乎不变,
故答案为:增大;减小;不变;
(3)丙中为K2SO4,相当于电解水,设电解的水的质量为x.由电解前后溶质质量相等有,100×10%=(100-x)×10.47%,得x=4.5g,故为0.25mol.
由方程式2H2+O2═2H2O可知,生成2molH2O,转移4mol电子,所以整个反应中转化0.5mol电子,
电极b发生:4OH--4e-=2H2O+O2↑,
则生成O2为$\frac{0.5mol}{4}$=0.125mol,标况下的体积为0.125×22.4=2.8L,
整个电路是串联的,所以每个烧杯中的电极上转移电子数是相等的,根据电极反应:Cu2++2e-=Cu,可知转移0.5mol电子生成的m(Cu)=$\frac{0.5}{2}$mol×64g/mol=16g.
故答案为:2.8L;16g;
(4)乙溶液中的电解反应的化学方程式为2CuSO4+2H2O$\frac{\underline{\;通电\;}}{\;}$2Cu+O2↑+2H2SO4,转移0.5mol电子,则阴极析出0.25molCu,阳极析出0.125mol氧气,相当于0.25molCuO,质量为0.25mol×80g/mol=20g,
故答案为:2CuSO4+2H2O$\frac{\underline{\;通电\;}}{\;}$2Cu+O2↑+2H2SO4;CuO;20.
点评 本题为电化学知识的综合应用,做题时要注意根据电极反应现象判断出电解池的阴阳级,进而判断出电源的正负极,要注意三个电解池为串联电路,各电极上得失电子的数目相等.做题时要正确写出电极方程式,准确判断两极上离子的放电顺序.


 名师点拨卷系列答案
名师点拨卷系列答案 英才计划期末调研系列答案
英才计划期末调研系列答案科目:高中化学 来源: 题型:推断题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 浓硫酸稀释时溶液温度升高,说明浓硫酸稀释只有水合过程 | |
| B. | 蔗糖是非电解质,放入水中溶液温度没有明显变化,说明蔗糖溶于水既没有扩散过程也没有水合过程 | |
| C. | 家用石碱(Na2CO3•10H2O)久置后,由块状变成粉末状,这一变化是风化的结果 | |
| D. | 从冰箱中取出物品,表面很快出现水珠,这种现象叫潮解 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 当lmol白磷转变成红磷时放出17kJ热量 | |
| B. | 当4g红磷转变成白磷时吸收17kJ热量 | |
| C. | 正反应是一个放热反应 | |
| D. | 白磷热稳定性比红磷大 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
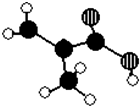 某化工厂生产的某产品A只含C、H、O三种元素,其分子模型如图所示(图中球与球之间的连线代表化学键,如单键、双键等).
某化工厂生产的某产品A只含C、H、O三种元素,其分子模型如图所示(图中球与球之间的连线代表化学键,如单键、双键等).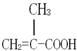 ,用1H核磁共振谱可以证明该化合物的核磁共振氢谱中有3个吸收峰.
,用1H核磁共振谱可以证明该化合物的核磁共振氢谱中有3个吸收峰.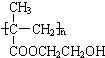 .
.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| 元素编号 | 元素性质与原子(或分子)结构 |
| T | 最外层电子数是次外层电子数的 3 倍 |
| X | 常温下单质为双原子分子,分子中含有 3 对共用电子对 |
| Y | M 层比 K 层少 1 个电子 |
| Z | 第 3 周期元素的简单离子中半径最小 |
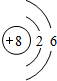
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A | B | C | D |
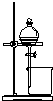 | 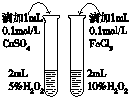 | 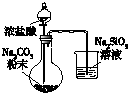 | 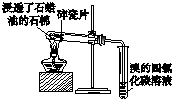 |
| 用于分离苯萃取碘水后的有机层和水层 | 比较不同种催化剂对反应速率的影响 | 验证酸性:H2CO3>H2SiO3 | 证明石蜡油分解生成的气体是乙烯 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
 .
.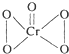 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com