
| 实验步骤 | 1.将一小块金属钠放入滴有酚酞溶液的冷水中; 2.将一小段用砂纸打磨后的镁带放入试管中,加入少量水,加热至水沸腾,冷却后,向试管中滴加酚酞溶液; 3.将一小段镁带投入稀盐酸中; 4.将一小片铝投入稀盐酸中. |
| 实验现象 | A.剧烈反应,迅速生成大量的气体 B.浮在水面上,熔成小球,不断游动,小球渐小最终消失,溶液变红 C.反应不剧烈,产生无色气体 D.有气体产生,溶液变成红色 |
| 实验步骤 | 1 | 2 | 3 | 4 |
| 实验现象 | B | D | A | C |
分析 越是活泼的金属,和酸或者水反应越剧烈,置换出氢气越容易,生成碱的碱性越强,据此分析.
解答 解:金属钠、镁、铝位于同一周期,按照从左到右的顺序失电子能力逐渐减小,钠为活泼金属,与冷水发生剧烈反应,由于钠的密度比水小,浮在水面上,钠的熔点较低,能迅速熔化成闪亮的小球,所以:1对应的现象为B;镁铝都是活泼金属,但镁的金属性较强,与盐酸反应较铝剧烈,2对应的现象为D,3对应的现象为A,4对应的现象为C,
故答案为:
| 实验步骤 | 1 | 2 | 3 | 4 |
| 实验现象 | B | D | A | C |
点评 本题考查学生同一周期元素性质的递变规律知识,题目难度不大,试题结合试验的方式考查,增加了题目的处理难度,注意熟练掌握元素周期律的内容及其应用.


科目:高中化学 来源: 题型:选择题
| A. | 17gNH3含有10nA个质子 | |
| B. | 标准状况下,22.4L氯水含有nA个Cl2分子 | |
| C. | 1mol C2H6含有6nA个共价键 | |
| D. | 1mol 金属K被完全氧化生成KO2,失去2nA个电子 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 如图是元素周期表的一部分,关于元素X、Y、Z的叙述正确的是( )
如图是元素周期表的一部分,关于元素X、Y、Z的叙述正确的是( )| A. | ①②③④ | B. | ①②③④⑤ | C. | 只有③ | D. | 只有①④ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 酸性:HClO4<HBrO4<HIO4 | B. | 碱性:NaOH>Mg(OH)2>Al(OH)3 | ||
| C. | 稳定性:HCl<H2S<PH3 | D. | 还原性:Cl->Br->I- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 蒸馏常用于分离提纯液态有机混合物 | |
| B. | 燃烧法是确定有机物成分的有效方法之一 | |
| C. | 红外光谱通常用于分析有机物的相对分子质量 | |
| D. | 核磁共振氢谱的研究有助于确定有机物分子中氢原子的类型和数目比 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 试剂 | 现象 | 结论 |
| A | 酸性KMnO4溶液 | 溶液褪色 | SO2有氧化性 |
| B | FeCl3溶液 | 溶液褪至浅绿色 | SO2有还原性 |
| C | 滴有酚酞的NaOH溶液 | 无明显变化 | SO2与NaOH溶液不反应 |
| D | 紫色石蕊试液 | 溶液变红后褪色 | SO2水溶液有漂白性 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 元素编号 | 元素性质与原子(或分子)结构 | |
| T | 最外层电子数是次外层电子数的3倍 | |
| X | 常温下单质为双原子分子,分子中含有3对共用电子对 | |
| Y | M层比K层少1个电子 | |
| Z | 第三周期元素的简单离子中半径最小 | |
| W | W带两个负电荷的阴离子与Ar具有相同电子层结构 | |
 .
.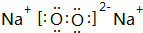 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com