
【题目】有机物D,质谱图表明其相对分子质量为86,将8.6gD完全燃烧的产物依次通过装有浓硫酸和碱石灰的装置,浓硫酸中增重9g,碱石灰中增重22g.其相关反应如图所示,其中B、D、E的结构中均含有2个﹣CH3,它们的核磁共振氢谱中均出现4个峰。

请回答:
(1)B中所含官能团的名称为________;D的分子式为________;
(2)Ⅲ的反应类型为________(填字母序号);
a.还原反应 b.加成反应 c.氧化反应 d.消去反应
(3)写出下列反应的化学方程式:
Ⅰ:___________________________________;
Ⅳ:__________________________________;
(4)C和E可在一定条件下反应生成F,F为有香味的有机化合物,该反应的化学方程式为________________________;
(5)A的同分异构体中有一对互为顺反异构,且结构中有2个﹣CH3 , 它们的结构简式为________和________;
(6)E的另一种同分异构体能发生银镜反应,能与足量金属钠生成氢气,不能发生消去反应,其结构简式为________.
【答案】溴原子 C5H10O a、b (CH3)2CHCH2CH2Br+NaOH![]() (CH3)2CHCH=CH2+NaBr+H2O (CH3)2CHCH2CHO+2Ag(NH3)2OH
(CH3)2CHCH=CH2+NaBr+H2O (CH3)2CHCH2CHO+2Ag(NH3)2OH![]() (CH3)2CHCH2COOH+2Ag↓+3NH3+H2O (CH3)2CHCH2CH2OH+(CH3)2CHCH2COOH
(CH3)2CHCH2COOH+2Ag↓+3NH3+H2O (CH3)2CHCH2CH2OH+(CH3)2CHCH2COOH![]() (CH3)2CHCH2COOCH2CH2CH(CH3)2+H2O
(CH3)2CHCH2COOCH2CH2CH(CH3)2+H2O 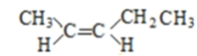
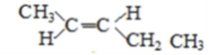
【解析】
有机物D,质谱图表明其相对分子质量为86,8.6gD该有机物的物质的量为:n=m/M=8.6g/86g/mol=0.1mol,浓硫酸吸收的是水,碱石灰吸收的是二氧化碳,水的物质的量=9g/18g/mol=0.5mol,二氧化碳的物质的量=22g/44g/mol=0.5mol,所以有机物、二氧化碳和水的物质的量之比=0.1mol:0.5mol:0.5mol=1:5:5,所以该有机物分子中含有5个碳原子、10个氢原子,该有机物的相对分子质量是86,86-5×12-10=16,所以该分子中还含有1个氧原子,其分子式为C5H10O,D的结构中含有2个-CH3,它的核磁共振氢谱中出现4个峰,说明该有机物中含4种类型的氢原子,则D为(CH3)2CHCH2CHO,D为醛,由转化关系可知,E为羧酸、C为醇、B为卤代烃,B可在NaOH乙醇溶液加热的条件下反应生成A,B转化为A发生消去反应,则A为烯烃,含有C=C,B、D、E的结构中均含有2个-CH3,它们的核磁共振氢谱中均出现4个峰,则C为(CH3)2CHCH2CH2OH,B为(CH3)2CHCH2CH2Br,A为(CH3)2CHCH=CH2,E为(CH3)2CHCH2COOH,据此解答.
(1)B为卤代烃,B可在NaOH乙醇溶液加热的条件下反应生成A,B转化为A发生消去反应,则A为烯烃,含有C=C,B、D、E的结构中均含有2个-CH3,它们的核磁共振氢谱中均出现4个峰,则C为(CH3)2CHCH2CH2OH,B为(CH3)2CHCH2CH2Br,含有的官能团为溴原子,D的结构简式为:(CH3)2CHCH2CHO,分子式为C5H10O,
故答案为:溴原子;C5H10O;
(2)反应Ⅲ为醛转化为醇,反应为:(CH3)2CHCH2CHO+H2![]() (CH3)2CHCH2CH2OH,属于加成反应,与氢气加成反应生成醇,也为还原反应,所以a、b符合条件,
(CH3)2CHCH2CH2OH,属于加成反应,与氢气加成反应生成醇,也为还原反应,所以a、b符合条件,
故答案为:a、b;
(3)反应Ⅰ为(CH3)2CHCH2CH2Br在乙醇作用下与NaOH反应生成烯烃,为消去反应,方程式为(CH3)2CHCH2CH2Br+NaOH![]() (CH3)2CHCH=CH2+NaBr+H2O,反应Ⅳ为(CH3)2CHCH2CHO与银氨试剂作用生成羧酸铵、银、氨气、水,为氧化反应,反应的方程式为:(CH3)2CHCH2CHO+2Ag(NH3)2OH
(CH3)2CHCH=CH2+NaBr+H2O,反应Ⅳ为(CH3)2CHCH2CHO与银氨试剂作用生成羧酸铵、银、氨气、水,为氧化反应,反应的方程式为:(CH3)2CHCH2CHO+2Ag(NH3)2OH![]() (CH3)2CHCH2COOH+2Ag↓+3NH3+H2O,故答案为:(CH3)2CHCH2CH2Br+NaOH
(CH3)2CHCH2COOH+2Ag↓+3NH3+H2O,故答案为:(CH3)2CHCH2CH2Br+NaOH![]() (CH3)2CHCH=CH2+NaBr+H2O;(CH3)2CHCH2CHO+2Ag(NH3)2OH
(CH3)2CHCH=CH2+NaBr+H2O;(CH3)2CHCH2CHO+2Ag(NH3)2OH![]() (CH3)2CHCH2COOH+2Ag↓+3NH3+H2O;
(CH3)2CHCH2COOH+2Ag↓+3NH3+H2O;
(4)C为(CH3)2CHCH2CH2OH,E为(CH3)2CHCH2COOH,在一定条件下反应生成F,F为有香味的有机化合物,F为酯,
故答案为:(CH3)2CHCH2CH2OH+(CH3)2CHCH2COOH![]() (CH3)2CHCH2COOCH2CH2CH(CH3)2+H2O;
(CH3)2CHCH2COOCH2CH2CH(CH3)2+H2O;
(5)A的同分异构体中有一对互为顺反异构,且结构中有2个-CH3,则它们的结构简式为
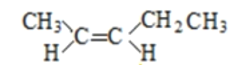
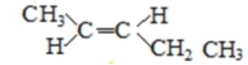 、
、
故答案为 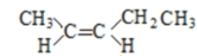 、
、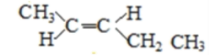 ;
;
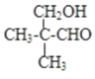
(6)E为(CH3)2CHCH2COOH,E的一种同分异构体能发生银镜反应,能与足量金属钠生成氢气,含有-CHO与-OH,且不能发生消去反应,其结构简式为: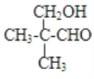 ,
,
故答案为: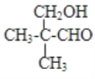 。
。


科目:高中化学 来源: 题型:
【题目】可逆反应2NO2(g)![]() 2NO(g)+O2(g),在体积固定的密闭容器中,可确定为平衡状态标志的命题中正确的有( )个
2NO(g)+O2(g),在体积固定的密闭容器中,可确定为平衡状态标志的命题中正确的有( )个
①单位时间内生成nmolO2的同时生成2nmolNO2;
②单位时间内生成nmolO2的同时生成2nmolNO;
③用NO2、NO、O2表示的反应速率的比为2∶2∶1的状态;
④混合气体的颜色不再改变的状态;
⑤混合气体的密度不再改变的状态;
⑥混合气体的压强不再改变的状态;
⑦混合气体的平均相对分子质量不再改变的状态;
⑧绝热容器内温度不再变化;
A.3个B.4个C.5个D.6个
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列物质的化学用语表达正确的是( )
A.甲烷的球棍模型: ![]() B.羟基的电子式:
B.羟基的电子式: ![]()
C.乙醛的结构式:CH3CHOD.(CH3)3COH的名称:2,2-二甲基乙醇
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学反应速率和限度与生产、生活密切相关。
(1)某学生为了探究锌与盐酸反应过程中的速率变化,在400mL稀盐酸中加入足量的锌粉,用排水集气法收集反应放出的氢气,实验记录如下(累计值):

①哪一时间段反应速率最大______min(填0~1、1~2、2~3、3~4、4~5),原因是_____。
②求3~4分钟时间段以盐酸的浓度变化来表示的该反应速率_________(设溶液体积不变)。
(2)另一学生为控制反应速率防止反应过快难以测量氢气体积,他事先在盐酸中加入等体积的下列溶液以减慢反应速率,你认为不可行的是____。
A.蒸馏水 B.KCl溶液 C.KNO3溶液 D.CuSO4溶液
(3)某温度下在4L密闭容器中,X、Y、Z三种气态物质的物质的量随时间变化曲线如图。
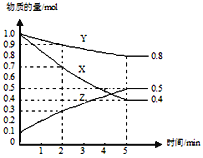
①该反应的化学方程式是_______。
②该反应达到平衡状态的标志是______
A.Y的体积分数在混合气体中保持不变
B.X、Y的反应速率比为3∶1
C.容器内气体压强保持不变
D.容器内气体的总质量保持不变
E.生成1mol Y的同时消耗2mol Z
③2min内Y的转化率为______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】芬太尼类似物L具有镇痛作用,它的合成方法如图:
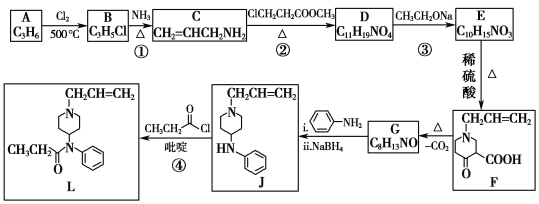
已知:
Ⅰ.![]() +Cl—R3
+Cl—R3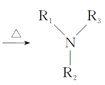 +HCl
+HCl
Ⅱ.R1COOR2+R3CH2COOR4![]()
![]() +R2OH
+R2OH
Ⅲ.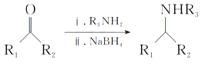 (R1、R2、R3、R4为氢原子或烃基)
(R1、R2、R3、R4为氢原子或烃基)
Ⅳ.RCH=CHR′![]() RCOOH+R′COOH,R、R′为烃基。
RCOOH+R′COOH,R、R′为烃基。
回答下列问题:
(1)A是一种烯烃,化学名称为__,其分子中最多有__个原子共面。
(2)B中官能团的名称为__、__。②的反应类型为__。
(3)③的化学方程式为__。
(4)碳原子上连有4个不同的原子或基团时,该碳原子称为手性碳原子。用星号(*)标出F中的手性碳原子__。G的结构简式为__,符合以下条件的G同分异构体有___种。
①能发生银镜反应
②结构中只含有一个环,该环结构为![]() ,环上只有一个侧链
,环上只有一个侧链
(5)已知④有一定的反应限度,反应进行时加入吡啶(一种有机碱),其作用是__。
(6)参照上述合成路线,写出以环己烯(![]() )和乙醇为起始原料制备化合物
)和乙醇为起始原料制备化合物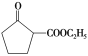 的合成路线(其他试剂任选)。___。
的合成路线(其他试剂任选)。___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将气体A、B置于固定容积为2 L的密闭容器中,发生如下反应:3A(g)+B(g)2C(g)+2D(g),反应进行到10 s末,达到平衡,测得A的物质的量为1.8 mol,B的物质的量为0.6 mol,C的物质的量为0.8 mol。
(1)用C表示10 s内反应的平均反应速率为________。
(2)反应前A的物质的量浓度是________。
(3)10 s末,生成物D的浓度为________。
(4)A与B的平衡转化率之比为________。
(5)反应过程中容器内气体的平均相对分子质量变化是________(填“增大”、“减小”或“不变”,下同),气体的密度变化是________。
(6)平衡后,若改变下列条件,生成D的速率如何变化(填“增大”、“减小”或“不变”):①降低温度______;②增大A的浓度________;③恒容下充入氖气_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度时,在2L容器中三种物质的物质的量随时间的变化曲线如下图所示。由图中数据分析,该反应的化学方程式和反应开始至2min末Z的平均反应速率为( )
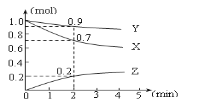
A.3X + Y ![]() 2Z;0.05mol·L-1·min-1B.2X + Y
2Z;0.05mol·L-1·min-1B.2X + Y![]() 2Z;0.1mol·L-1·min-1
2Z;0.1mol·L-1·min-1
C.X + 2Y =Z;0.1mol·L-1·min-1D.X + 3Y =2Z;0.05mol·L-1·min-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在容积不变的密闭容器中,一定条件下发生反应:2A(?) ![]() B(g)+2C(g),且达到平衡。当升高温度时气体的密度增大,则下列叙述中正确的是 ( )
B(g)+2C(g),且达到平衡。当升高温度时气体的密度增大,则下列叙述中正确的是 ( )
A.升高温度,正反应速率增大,逆反应速率减小B.若正反应是放热反应,则A为气态
C.物质A一定为非气态,且正反应是吸热反应D.若向容器中充入惰性气体,则平衡向左移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上乙醚可用于制造无烟火药。实验室合成乙醚的原理如下:2CH3CH2OH![]() CH3CH2OCH2CH3+H2O。
CH3CH2OCH2CH3+H2O。
(乙醚制备)装置设计如图(部分装置略)
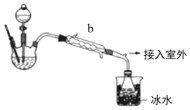
(1)仪器b应更换为下列的___(填序号)。
A.干燥器 B.直形冷凝管 C.玻璃管 D.安全瓶
(2)反应温度控制在145℃,还需添加___以防止局部过热,若温度过高,会生成一种能催熟果实的气体,则副反应化学方程式为:___。
(3)反应时,若滴入乙醇的速率显著超过馏出液速率,反应速率会降低,可能原因是___。
(乙醚提纯)
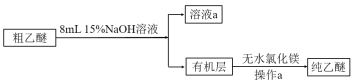
(4)粗乙醚中含有的主要杂质为___;操作a的名称是___;无水氯化镁的作用是___。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com