
分析 影响反应速率的因素有:温度、浓度、压强、催化剂、反应物接触面积等,温度和催化剂是通过改变活化分子百分数来改变反应速率,浓度、压强是通过改变单位体积内活化分子个数来改变反应速率,以此解答该题.
解答 解:①粉碎成矿粒增大了固体表面积,即影响因素为固体表面积,故答案为:固体表面积;
②MnO2起催化作用,即影响因素为催化剂,故答案为:催化剂;
③镁的活泼性比锌强,即影响因素为反应物本身的性质,故答案为:反应物本身的性质;
④盐酸的浓度不同反应速率不同,即影响因素为浓度,故答案为:浓度;
⑤夏天温度高于冬天,温度越高,活化分子百分数越大,其反应速率越大,所以食品在夏天容易变质,冬天则不会出现该现象,故答案为:温度.
点评 本题考查化学反应速率影响因素,为高频考点,明确温度、压强、浓度、催化剂、反应物接触面积对化学反应速率影响原理是解本题关键,题目难度不大.


 全能测控一本好卷系列答案
全能测控一本好卷系列答案科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
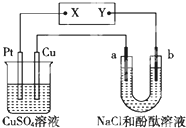
| A. | X是正极,Y是负极 | |
| B. | NaCl溶液中的Cl-移向b极 | |
| C. | CuSO4溶液的pH不变 | |
| D. | 理论上,a和b生成的气体的物质的量之比为1:2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | $\frac{1}{K}$ | B. | K2 | C. | ($\frac{1}{K}$)2 | D. | $(K)^{-\frac{1}{2}}$ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 若 pH>7,则一定是 c1V1═c2V2 | |
| B. | 在任何情况下都是 c(Na+)+c(H+)═c(CH3COO-)+c(OH-) | |
| C. | 当 pH=7 时,若 V1=V2,则一定是 c1<c2 | |
| D. | 若 V1=V2、c1=c2,则 c(CH3COO-)+c(CH3COOH)═c(Na+) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
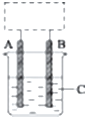 某学生设计了如图所示的装置(框内部分未画出),在装置内起初发生的反应为Cu+H2SO4═H2↑+CuSO4(未注明反应条件),试回答:
某学生设计了如图所示的装置(框内部分未画出),在装置内起初发生的反应为Cu+H2SO4═H2↑+CuSO4(未注明反应条件),试回答:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com