
����Ŀ�����������FexNy���ڴż�¼�����������Ź㷺��Ӧ��ǰ����ijFexNy���Ʊ���������������ͪ���Ҵ����롣
��1����ͪ(CH3COCH3)������2��̼ԭ�ӹ�����ӻ�������__��1mol��ͪ�����к�����������ĿΪ___mol��
��2��C��H��O����Ԫ�صĵ縺����С�����˳��Ϊ__��������дԪ�����ƣ���Ҫ���κ����ӷ��ţ�
��3��ijFexNy�ľ�����ͼ1��ʾ��Cu������ȫ����þ�����aλ��Fe����bλ��Fe���γ�Cu����Ͳ���Fe(x��n)CunNy��FexNyת��Ϊ����Cu����Ͳ���������仯��ͼ2��ʾ�����и��ȶ���Cu����Ͳ���Ļ�ѧʽΪ__��
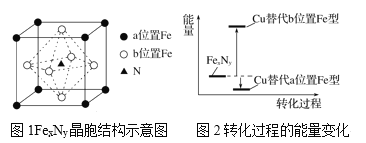
���𰸡�sp2 9 ��̼�� Fe3CuN
��������
��1��![]() �е�����Ϊ������˫���к�1������������C�γ�4��������C=O��C�γ�3��������
�е�����Ϊ������˫���к�1������������C�γ�4��������C=O��C�γ�3��������
��2���ǽ�����Խǿ���縺��Խ��
��3����ͼ2��֪��Cu���aλ�õ�Feʱ�����ϵͣ����ȶ�����Cuλ�ڶ��㣬N��Cu��=8��![]() =1��Feλ�����ģ�N��Fe��=6��
=1��Feλ�����ģ�N��Fe��=6��![]() =3��Nλ�����ġ�
=3��Nλ�����ġ�
��1��![]() �е�����Ϊ������˫���к�1������������C�γ�4��������C=O��C�γ�3��������2��̼Ϊ�ʻ���C��Ϊsp2�ӻ�������CΪsp3�ӻ���1mol��ͪ����9mol�������ʴ�Ϊ��sp2��9��
�е�����Ϊ������˫���к�1������������C�γ�4��������C=O��C�γ�3��������2��̼Ϊ�ʻ���C��Ϊsp2�ӻ�������CΪsp3�ӻ���1mol��ͪ����9mol�������ʴ�Ϊ��sp2��9��
��2���ǽ�����Խǿ���縺��Խ����C.H��O����Ԫ�صĵ縺����С�����˳��Ϊ��̼�����ʴ�Ϊ����̼����
��3����ͼ2��֪��Cu���aλ�õ�Feʱ�����ϵͣ����ȶ�����Cuλ�ڶ��㣬N��Cu��=8��![]() =1��Feλ�����ģ�N��Fe��=6��
=1��Feλ�����ģ�N��Fe��=6��![]() =3��Nλ����������ֻ��1��N���仯ѧʽΪFe3CuN���ʴ�Ϊ��Fe3CuN��
=3��Nλ����������ֻ��1��N���仯ѧʽΪFe3CuN���ʴ�Ϊ��Fe3CuN��


 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ṹ���о����л���ѧ����Ҫ���о�����ij�л���X��C12H13O6Br�������к��ж��ֹ����ţ���ṹ��ʽ���£���������Ϊδ֪���ֵĽṹ����

Ϊ�Ʋ�X�ķ��ӽṹ��������ͼת����
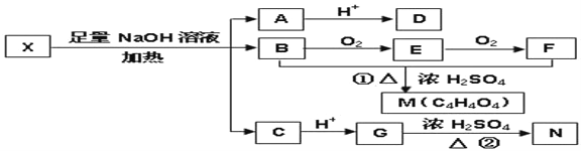
��֪��D��ˮ��Һ�е���FeCl3��Һ����ɫ����D�Ľṹ���й�����������˴Ź���������ʾֻ�������źţ�M��N��Ϊͬ���칹�壬M�к���һ����ԭ�ӻ���N��ʹ������Ȼ�̼��Һ��ɫ��G����NaHCO3��Һ��Ӧ����ش�
��1��G�������������ŵ�������__��
��2��D�����Է����ķ�Ӧ�У�ѡ����ţ�__��
�ټӳɷ�Ӧ ����ȥ��Ӧ ��������Ӧ ��ȡ����Ӧ
��3��д����ͼת���з�Ӧ�ٺ͢ڵĻ�ѧ����ʽ
��B+F��M__��
��G��N__��
��4����֪��X�м���FeCl3��Һ���ܷ�����ɫ��Ӧ����X�Ľṹ��ʽ�ǣ�___________��1mol�� X��������NaOH��Һ���ã���������NaOH__mol��
��5����һ�ֻ�����Ʒ���м���W��G��Ϊͬ���칹�壬W�ķ�����ֻ�����Ȼ����ǻ���ȩ�����ֹ����ţ���ͬһ��̼ԭ���ϲ���ͬʱ���������ǻ�����W�ķ��ӽṹ��__�֣�д������һ�ֵĽṹ��ʽ___________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������ţ�10000
����ţ�2427322248593408
�ܵĻ������ڹ�ҵ�����������Ƽ�����ҵ����ҪӦ�á�
(1)Co2+�ĺ�������Ų�ʽΪ____��Co�ĵ��ĵ����ܱ�Fe�ĵ��ĵ�����ҪС�ö࣬ԭ����____��
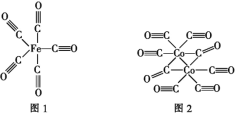
(2)Fe��Co������CO�γ�������Fe(CO)5��Co2(CO)8�Ľṹ��ͼ1��ͼ2��ʾ��ͼ1��1molFe(CO)5����____mol��λ����ͼ2��Cԭ�ӵ��ӻ���ʽΪ____���γ��������ֻ����������Ԫ���е縺��������____(��Ԫ�ط���)��
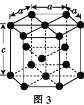
(3)�����ܵĶѻ���ʽΪ�������ܶѻ�������λ����____���ܾ��徧���ṹ��ͼ3��ʾ���þ�����ԭ�Ӹ���Ϊ____���þ����ı߳�Ϊanm����Ϊcnm���þ������ܶ�Ϊ____(NA��ʾ�����ӵ�������ֵ���г�����ʽ)g��cm-3��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������ƣ�NaBiO3���Ƿ�����ѧ�е���Ҫ�Լ�����ˮ�л����ֽ⣬����ˮ������Ѹ�ٷֽ⡣ij��ȤС�����ʵ����ȡ�����Ʋ�̽����Ӧ�á��ش��������⣺
��.��ȡ������
��ȡװ����ͼ�����Ⱥͼг���������ȥ�������������������£�
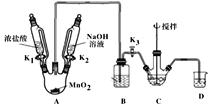
���� | NaBiO3 | Bi(OH)3 |
���� | ��������ˮ��dz��ɫ | ������ˮ����ɫ |
��1��Bװ�����ڳ�ȥHCl��ʢ�ŵ��Լ���___��
��2��C��ʢ��Bi(OH)3��NaOH������Cl2��Ӧ����NaBiO3����Ӧ�����ӷ���ʽΪ___��
��3�����۲쵽___��������ʱ�����Գ����ж�C�з�Ӧ�Ѿ���ɣ�
��4�����װ��ǰ�����ȳ�ȥ��ƿ�в���Cl2������Ⱦ��������ȥCl2�IJ�����___��
��5����Ӧ������Ϊ��װ��C�л�þ����ܶ�IJ�Ʒ����Ҫ�IJ�����___��
��.�����Ƶ�Ӧ����������Mn2+
��6��������Һ�м��������ƾ��壬�������ữ����Һ��Ϊ�Ϻ�ɫ��֤������Һ�д���Mn2+��
�ٲ����Ϻ�ɫ��������ӷ���ʽΪ___��
��ijͬѧ�ڽ�Ũ��MnSO4��Һ�м��������ƾ��壬�������ữ�����û���Ϻ�ɫ���֣����۲쵽��ɫ���壨MnO2�����ɡ���������������ӷ�Ӧ����ʽΪ___��
��.��Ʒ���ȵIJⶨ
��7��ȡ����NaBiO3��Ʒwg����������ϡ�����MnSO4ϡ��Һʹ����ȫ��Ӧ������cmo1��L-1��H2C2O4����Һ�ζ����ɵ�MnO4-����֪��H2C2O4+MnO4-����CO2+Mn2++H2O��δ��ƽ��������Һ�Ϻ�ɫǡ����ȥʱ������vmL����Һ��
�ò�Ʒ�Ĵ���Ϊ___���ú�w��c��v�Ĵ���ʽ��ʾ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ͨ����ԭ�������ͼ۵���������ͬ�ķ��ӻ����ӳ�Ϊ�ȵ����壮���Ƿ��ֵȵ�����Ŀռ�ṹ��ͬ���������й�˵������ȷ���ǣ� ��
A.B3N3H6�����д���˫�����ɷ����ӳɷ�Ӧ
B.B3N3H6�ͱ��ǵȵ����壬B3N3H6�����в����ڡ��粢�硱ʽ�ص��Ĺ��
C.NH3��PCl3�ǵȵ����壬��Ϊ�����νṹ
D.BF3��CO![]() �ǵȵ����壬��Ϊƽ���������νṹ
�ǵȵ����壬��Ϊƽ���������νṹ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��һ�������£�CO2���Ӿ����ת��Ϊ��������SiO2�ṹ��ԭ�Ӿ��壮�������Ϸ���������˵����ȷ���ǣ�������
A.��ת�������������仯
B.1molCO2ԭ�Ӿ����к�2mol C��O��
C.CO2ԭ�Ӿ�����۵����SiO2
D.CO2��ԭ�Ӿ���ͷ��Ӿ��廥Ϊͬ���칹��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ʳ��ˮ�м���̼����刺��Ʊ�С�մ��˳�С�մ����ĸҺ��ͨ�백������ȴ����ʳ�Σ����ˣ��õ��Ȼ�粒��壮���з���������ǣ�������
A.���Ʊ�С�մ�ķ���ʽΪ��NaCl+NH4HCO3��NaHCO3��+NH4Cl
B.ĸҺ��ͨ��İ�����HCO3����Ӧ��NH3+HCO3����CO32��+NH4+
C.��ʳ����Ϊ������Һ��Cl����Ũ��
D.�����֪�¶Ƚϵ�ʱ���Ȼ�淋��ܽ�ȱ��Ȼ��ƵĴ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����ú�̼������ϳ�ȼ���ǽ����ԴΣ������Ҫ��������֪úҺ���������з�ӦCO(g)+2H2(g)=CH3OH(g)���䷴Ӧ�����е������仯�����ͼ��ʾ�����ߢ�����ߢ�ֱ��ʾ��ʹ�ô�����ʹ�ô�������������������ж���ȷ���ǣ� ��
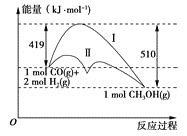
A.�÷�Ӧ�ķ�Ӧ����H=+91kJ��mol-1
B.��������÷�Ӧ����H��С
C.��Ӧ��������������������������
D.��ͼ�п��Կ�����ʹ�ô��������˸÷�Ӧ�Ļ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��(1)����ʽΪC8H10�ķ�����ͬ���칹��Ľṹ��ʽ��_____�֡�
(2)�����ϵ�һ����ԭ�ӱ���ԭ��ȡ�������ɵ�ͬ���칹����Ŀ���ٵ���_____����ṹ��ʽ����ͬ������һ�ȴ���Ľṹ��ʽ��_____
(3)_____��һ�ȴ���������ࡣ
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com