
室温时,某溶液中由水电离生成的H+和OH-物质的量浓度的乘积为1×10-24,则在该溶液中一定不能大量共存的离子组是
A.Al3+、Na+、NO、Cl- B.K+、Na+、Cl-、CO
C.NH、Na+、Cl-、SO D.NH、K+、SiO、NO
科目:高中化学 来源:2015-2016学年山西省高二5月月考文科化学试卷(解析版) 题型:选择题
下列行为不符合安全要求的是
A.做实验剩余的金属钠直接丢弃在废液缸中
B.闻气体时用手轻轻扇动,使少量气体飘进鼻孔
C.配制稀硫酸时将浓硫酸慢慢倒入水中并不断搅拌
D.不慎洒出的酒精在桌上着火时,立即用湿毛巾盖灭
查看答案和解析>>
科目:高中化学 来源:2015-2016学年四川省高二4月月考化学试卷(解析版) 题型:填空题
常温下,某水溶液M中存在的离子有Na+、A-、H+、OH-。根据题意回答下列问题:
(1)若溶液M由0.1 mol·L-1的HA溶液与0.1 mol·L-1的NaOH溶液等体积混合而得,则溶液M的pH不可能________7(填“>”、“<”或“=”)。
(2)若溶液M的pH>7,则c(Na+)________c(A-)(填“>”、“<”或“=”)。
(3)常温下,若溶液M由pH=3的HA溶液V1 mL与pH=11的NaOH溶液V2 mL混合反应而得,则下列说法中正确的是________(填字母)。
A.若溶液M呈中性,则溶液M中c(H+)+c(OH-)=2×10-7 mol·L-1
B.若V1=V2,则溶液M的pH一定等于7
C.若溶液M呈酸性,则V1一定大于V2
D.若溶液M呈碱性,则V1一定小于V2
查看答案和解析>>
科目:高中化学 来源:2015-2016学年四川省高二4月月考化学试卷(解析版) 题型:选择题
在恒容密闭容器中通入X并发生反应:2X(g)  Y(g),温度T1、T2下X的物质的量浓度c(X)随时间t变化的曲线如图所示。下列叙述正确的是
Y(g),温度T1、T2下X的物质的量浓度c(X)随时间t变化的曲线如图所示。下列叙述正确的是

A.该反应进行到M点放出的热量大于进行到W点放出的热量
B.T2下,在0 ~t1时间内,v(Y)=mol·L-1·min-1
C.M点的正反应速率V正大于N点的逆反应速率V逆
D.M点时再加入一定量X,平衡后X的转化率减小
查看答案和解析>>
科目:高中化学 来源:2015-2016学年四川省高二4月月考化学试卷(解析版) 题型:选择题
某蓄电池的反应为:Fe+Ni2O3+3H2O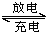 Fe(OH)2+2Ni(OH)2 ,下列推断中正确的是
Fe(OH)2+2Ni(OH)2 ,下列推断中正确的是
①放电时,Fe为正极,Ni2O3为负极
②充电时,阴极上的电极反应式是Fe(OH)2+2e-===Fe+2OH-
③充电时,Ni(OH)2为阳极
④蓄电池的电极必须是浸在某种碱性电解质溶液中
A.①②③ B.①②④ C.①③④ D.②③④
查看答案和解析>>
科目:高中化学 来源:2016届安徽省高三下学期适应性考试理综化学试卷(解析版) 题型:实验题
某工厂对工业生产钛白粉产生的废液进行综合利用,废液中含有大量FeSO4、H2SO4和少量Fe2(SO4)3、TiOSO4,可用于生产颜料铁红和补血剂乳酸亚铁.其生产工艺流程如下:
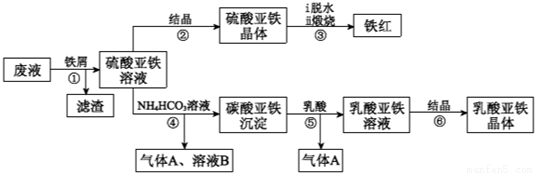
已知:①TiOSO4可溶于水,在水中可以电离为TiO2+和SO42-;
②TiOSO4水解的反应为:TiOSO4+(x+1)H2O→TiO2•xH2O↓+H2SO4.
请回答:
(1)步骤①所得滤渣的主要成分为_____________,
(2)步骤③硫酸亚铁在空气中煅烧生成铁红和三氧化硫,该反应中氧化剂和还原剂的物质的量之比为_____________,
(3)步骤④需控制反应温度低于35℃,其目的是_____________,
(4)步骤④的离子方程式是_____________,
(5)已知:FeCO3(S) Fe2+(aq)+CO32-(aq),试用平衡移动原理解释步骤⑤生成乳酸亚铁的原因_____________,
Fe2+(aq)+CO32-(aq),试用平衡移动原理解释步骤⑤生成乳酸亚铁的原因_____________,
(6)溶液B常被用于电解生产(NH4)2S2O8(过二硫酸铵)。电解时均用惰性电极,阳极发生的电极反应可表示为_____________,
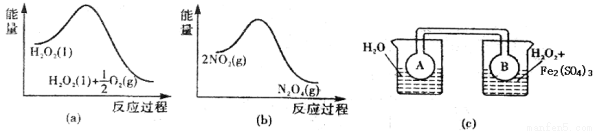
(7)Fe3+对H2O2的分解具有催化作用.利用图2(a)和(b)中的信息,按图2(c)装置(连通的A、B瓶中已充有NO2气体)进行实验.可观察到B瓶中气体颜色比A瓶中的深,其原因是_____________。
查看答案和解析>>
科目:高中化学 来源:2016届安徽省高三最后一卷理综化学试卷(解析版) 题型:选择题
下列有关实验的说法正确的是
A.将少量SO2通入氨水和硝酸钡的混合溶液中产生白色沉淀,说明NO3-将SO2氧化生成了硫酸钡
B.“中和滴定”实验中,容量瓶和锥形瓶用蒸馏水洗净后即可使用,滴定管和移液管用蒸馏水洗净后,必须干燥或润洗后方可使用
C.为除去乙酸乙酯中混有的少量乙酸杂质,可向混合溶液中加入适量的乙醇并加热
D.已知I3-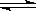 I2+I-,向盛有KI3溶液的试管中加入适量CCl4,振荡静置后CCl4层显紫色,说明KI3在CCl4中的溶解度比在水中的大
I2+I-,向盛有KI3溶液的试管中加入适量CCl4,振荡静置后CCl4层显紫色,说明KI3在CCl4中的溶解度比在水中的大
查看答案和解析>>
科目:高中化学 来源:205-2016学年吉林省高二下学期期中化学试卷(解析版) 题型:选择题
普伐他汀是一种调节血脂的药物,其结构如图所示(未表示出其空间构型)。下列关于普伐他汀的性质描述正确的是( )
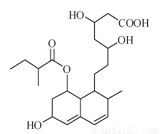
A.不能通过反应形成高分子化合物
B.不能使酸性KMnO4溶液褪色
C.能发生加成、取代、消去反应
D.1mol该物质最多可与1molNaOH反应
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com