
【题目】下列关于物质的用途的说法不正确的是
A. 磁性氧化铁可用于制备红色颜料和油漆
B. 氢氧化铝、碳酸氢钠可用于治疗胃酸过多
C. 钢罐可用于储运浓硫酸
D. SO2可用于漂白纸浆
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】【2017届福建省四地六校高三上学期12月月考】
由N2O和NO反应生成N2和NO2的能量变化如图所示。下列说法正确的是( )
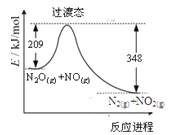
A.断键吸收能量之和大于成键释放能量之和
B.反应物总能量小于生成物总能量
C.N2O(g) +NO(g) =N2(g) +NO2(g)△H= -139kJ/mol
D.反应生成1 mol N2时转移4 mol电子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列事实不能用勒夏特列原理解释的是
A.开启啤酒瓶后,瓶中立刻泛起大量泡沫
B.由H2、I2蒸气、HI组成的平衡体系加压后颜色变深
C.向氯水中加CaCO3后,溶液漂白性增强
D.在含有[Fe(SCN)]2+的红色溶液中加铁粉,振荡静置,溶液颜色变浅或褪去
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】【2017上海模拟】升高温度,下列数据不一定增大的是( )
A.化学反应速率v B.弱电解质的电离度α
C.化学平衡常数K D.水的离子积常数Kw
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】中学化学常见的物质分离与提纯的方法有过滤、分液、萃取、蒸发、蒸馏等,根据如图装置回答:
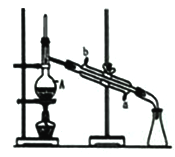
(1)仪器A的名称为______。
(2)“分离NaOH的乙醇溶液”不能用此装置的原因为_______。
(3)下列说法正确的是___________。
A.冷凝管中水流方向为a进b出
B.如果忘加沸石,可快速将沸石加入将近沸腾的液体中
C.蒸馏时可以用球型冷凝管代替直型冷凝管
D.温度计水银球位置过低,会导致收集到的产品中混有低沸点杂质
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.甲醇是重要的化学工业基础原料和清洁液体燃料。工业上可利用CO或CO2来生产燃料甲醇。已知甲醇制备的有关化学反应以及在不同温度下的化学反应平衡常数如下表所示:
化学反应 | 平衡 常数 | 温度/℃ | |
500 | 800 | ||
①2H2(g)+CO(g) | K1 | 2.5 | 0.15 |
②H2(g)+CO2(g) | K2 | 1.0 | 2.50 |
③3H2(g)+CO2(g) | K3 | ||
(1) 据反应①与②可推导出K1、K2与K3之间的关系,则K3=________(用K1、K2表示)。500 ℃时测得反应③在某时刻,H2(g)、CO2(g)、CH3OH(g)、H2O(g)的浓度(mol·L-1)分别为0.8、0.1、0.3、0.15,则此时v正__________v逆(填“>”、“=”或“<”)。
(2) 对于反应③,在相同温度和容积不变时,能说明该反应已达平衡状态的是
A.n(CO2)∶n(H2)∶n(CH3OH)∶n(H2O)=1∶3∶1∶1
B.容器内压强保持不变
C.H2的消耗速率与CH3OH的消耗速率之比为3∶1
D.容器内的密度保持不变
Ⅱ.超音速飞机在平流层飞行时,尾气中的NO会破坏臭氧层。科学家正在研究利用催化技术将尾气中的NO和CO转变成CO2和N2,化学方程式如下:2NO(g)+2CO(g)![]() 2CO2(g)+N2(g)ΔH<0
2CO2(g)+N2(g)ΔH<0
为了测定在某种催化剂作用下的反应速率,在某温度下用气体传感器测得不同时间的NO和CO浓度如表:
时间(s) | 0 | 1 | 2 | 3 | 4 | 5 |
c(NO)(mol/L) | 1.00×10-3 | 4.50×10- 4 | 2.50×10- 4 | 1.50×10- 4 | 1.00×10- 4 | 1.00×10- 4 |
c(CO)(mol/L) | 3.60×10- 3 | 3.05×10- 3 | 2.85×10- 3 | 2.75×10- 3 | 2.70×10- 3 | 2.70×10- 3 |
请回答下列问题(均不考虑温度变化对催化剂催化效率的影响):
(1)前2s内的平均反应速率υ(N2)= ,CO的平衡转化率为____________。(结果均保留两位有效数字)
(2)写出该反应的平衡常数K的表达式________________。
(3)假设在密闭容器中发生上述反应,达到平衡时下列措施能提高NO转化率的是 。
A.选用更有效的催化剂 B.升高反应体系的温度
C.降低反应体系的温度 D.缩小容器的体积
(4)研究表明:在使用等质量催化剂时,增大催化剂比表面积可提高化学反应速率。某同学设计了三组实验,实验条件已经填在下面实验设计表中。
实验 编号 | T(℃) | NO初始浓度 (mol/L) | CO初始浓度 (mol/L) | 催化剂的比表面积(m2/g) |
Ⅰ | 280 | 1.20×10-3 | 5.80×10-3 | 82 |
Ⅱ | 280 | 1.20×10-3 | 5.80×10-3 | 124 |
Ⅲ | 350 | 1.20×10-3 | 5.80×10-3 | 124 |
①以上三组实验的实验目的是_______________________。
②请在给出的坐标图中,画出上表中的第三个实验条件下混合气体中NO浓度随时间变化的趋势曲线图。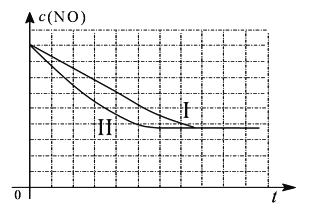
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于胶体和溶液的说法中,正确的是:
A.胶体不均一、不稳定,静置后易产生沉淀;溶液均一、稳定,静置后不产生沉淀
B.布朗运动是胶体粒子特有的运动方式,可以据此把胶体与溶液、悬浊液区分
C.光线通过时,胶体产生丁达尔效应,溶液则无丁达尔效应
D.只有胶状的物质如胶水、果冻类的才能称为胶体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NaHSO4和NaHCO3是常见的酸式盐,是水溶液中离子平衡部分重要的研究对象。请运用相关原理,回答下列有关小题。
(1)NaHSO4在水中的电离方程式为 。室温下,pH=5的NaHSO4溶液中水的电离程度 (填“>”、”=”或“<”)pH=9的氨水中水的电离程度。
(2)等体积等物质的量浓度的NaHSO4与氨水混合后,溶液呈酸性的原因为 (用离子方程式表示)。
(3)室温下,若一定量的NaHSO4溶液与氨水混合后,溶液pH=7,则c(Na+)+c(NH) c(SO![]() )(填“>”、“=”或“<”)。
)(填“>”、“=”或“<”)。
(4)室温下,用硫酸氢钠与氢氧化钡溶液制取硫酸钡,若溶液中SO![]() 完全沉淀,则反应后溶液的pH__________7(填“>”、”=”或“<”)。
完全沉淀,则反应后溶液的pH__________7(填“>”、”=”或“<”)。
(5)室温下,0.1 mol/L 的NaHCO3溶液的pH为8.4,同浓度的NaAlO2溶液的pH为12.4,同浓度的Na2CO3溶液的pH是11.4。
①将NaHCO3溶液和NaAlO2溶液等体积混合,可能发生的现象是 ,其主要原因是 (用离子方程式表示)。
②上述溶液中,由NaHCO3水解产生的c(OH-)是由 Na2CO3水解产生c(OH-)的 倍。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】科学家在研究生物体的化学成分时,发现组成生物体的元素在非生物界中都存在,只是含量不同,以上事实主要说明
A. 生物界与非生物界没有差别
B. 生物来源于非生物
C. 生物界与非生物界具有统一性和差异性
D. 生物界与非生物界具有统一性
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com