
 滴定法是一种用于测定的非常重要的方法.
滴定法是一种用于测定的非常重要的方法.| c(标准)×V(标准) |
| V(待测) |
| m(草酸) |
| 3.00g |
| c(标准)×V(标准) |
| V(待测) |
| 0.100mol/L×20.00mL |
| 25.00mL |
| 0.008mol×134g/mol |
| 3.00g |
| 2.0×10-10 |
| 1.0×10-5 |
| 2.0×10-12 |
| (2.0×10-5)2 |
| 58.5g×cV×10-3mol |
| 1mol |
| 5.85cV×10-3×10 |
| m |
| 5.85cV×10-3×10 |
| m |


 全能练考卷系列答案
全能练考卷系列答案 一课一练课时达标系列答案
一课一练课时达标系列答案科目:高中化学 来源: 题型:
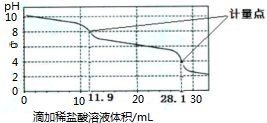
| A、上一个计量点前发生反应的离子方程式为HCO3-+H+═H2O+CO2↑ |
| B、下一个计量点溶液中存在大量的阴离子是Cl-、HCO3- |
| C、此样品n(NaHCO3)=(28.1-2×11.9)×10-3 mol |
| D、使用该方法测定Na2CO3和NaOH混合溶液中的氢氧化钠含量,将会得到1个计量点 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| 滴定序号 | 待测液体积 | 所消耗盐酸标准的体积(mL) | |
| 滴定前 | 滴定后 | ||
| 1 | 25.00 | 0.50 | 20.60 |
| 2 | 25.00 | 6.00 | 26.00 |
| 3 | 25.00 | 1.10 | 21.00 |
查看答案和解析>>
科目:高中化学 来源: 题型:
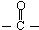 )的化合物反应生成醇,其过程可表示如下:
)的化合物反应生成醇,其过程可表示如下: (-R1、-R2表示烃基)
(-R1、-R2表示烃基)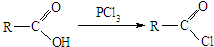
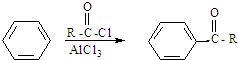
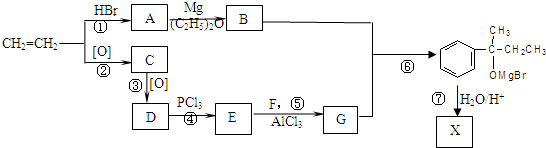
查看答案和解析>>
科目:高中化学 来源: 题型:
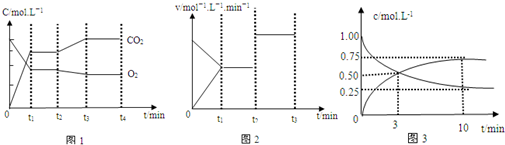
查看答案和解析>>
科目:高中化学 来源: 题型:
 某小组学生想研究不同物质对双氧水分解速率的影响,以生成气体量50mL为标准,设计了如下实验方案:
某小组学生想研究不同物质对双氧水分解速率的影响,以生成气体量50mL为标准,设计了如下实验方案:| 实验序号 | 双氧水体积 | 双氧水浓度 | 添加的物质 | 待测数据X |
| 1 | 100mL | 20% | 无 | |
| 2 | 100mL | 20% | 10gMnO2 | |
| 3 | 100mL | 20% | 10gKI | |
| 4 | 100mL | 20% | 新鲜猪肝 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、只② | B、只②③⑤ |
| C、只②③④ | D、①②③④⑤ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com