
【题目】化学反应中的能量变化是由化学反应中旧化学键断裂时吸收的能量与新化学键形成时放出的能量不同引起的.如图为N2(g)和O2(g)反应生成NO(g)过程中的能量变化.下列说法正确的是( ) 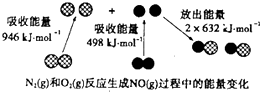
A.1 mol N2(g)和1 mol O2(g)反应放出的能量为180 kJ
B.1 mol N2(g)和1 mol O2(g)具有的总能量小于2 mol NO(g)具有的总能量
C.通常情况下,N2(g)和 O2混合能直接生成NO
D.NO是一种酸性氧化物,能与NaOH溶液反应生成盐和水
【答案】B
【解析】解:A、焓变=反应物断裂化学键吸收的能量﹣生成物形成化学键放出的能量,N2+O2═2NO,△H=946kJ/mol+498kJ/mol﹣2×632kJ/mol=+180kJ/mol,反应是吸热反应,故A错误;
B、由图中数据可得反应物键的断裂吸收(946+498)=1444kJ/mol的能量,生成物键的形成放出2×632=1264 kJ/mol的能量,故该反应是吸热反应,依据能量守恒,1 mol N2(g)和1 mol O2(g)具有的总能量小于2 mol NO(g)具有的总能量,故B正确;
C、通常情况下,N2(g)和O2(g)混合不能直接生成NO,需要放电条件,故C错误;
D、一氧化氮不能和氢氧化钠反应,不是酸性氧化物,故D错误;
故选:B.
A、分析能量变化黑球代表氧原子,依据反应焓变=反应物断裂化学键吸收的能量﹣生成物形成化学键放出的能量计算判断;
B、依据A计算的焓变判断反应能量变化,结合反应前后能量守恒分析;
C、氮气和氧气在放电条件才能反应;
D、一氧化氮不能和氢氧化钠反应.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】在0.1 mol/L CH3COOH溶液中存在如下电离平衡:CH3COOH![]() CH3COO-+H+,对于该平衡,下列叙述正确的是
CH3COO-+H+,对于该平衡,下列叙述正确的是
A. 加入水时,平衡逆向移动
B. 加入少量NaOH固体,平衡正向移动
C. 加入少量0.1 mol/L HCl溶液,溶液中c(H+)不变
D. 加入少量CH3COONa固体,平衡正向移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A,B,C均为短周期元素,它们在周期表中的位置如图所示.已知:B,C两元素原子最外层电子数之和等于A元素原子最外层电子数的2倍;B,C两元素的核电荷数之和是A元素原子序数的4倍.则A,B,C分别是( ) 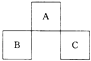
A.C,Al、P
B.N,Si、S
C.O,P,Cl
D.F,S,Ar
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将气体A、B置于体积为1L的密闭容器中,发生如下反应:4A(g)+B(g) =2C(g) 反应进行到4s末,测得A为0.5 mol,B为0.4 mol, C为0.2mol。则用v(A)表示的该反应的速率为________,用v(B)表示的该反应的速率为________,用v(C)表示的该反应的速率为_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于2008年北京奥运会所用材料中,属于有机合成材料的是( )
A.用羊绒作外层材料制作吉祥物——“福娃”
B.用轻薄高品质铝合金制作奥运会火炬——“祥云”
C.用合金高强度钢材铸造国家体育场——“鸟巢”
D.用ETFE膜(聚四氟乙烯一乙烯共聚物)建造国家游泳中心——“水立方”
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列物质依次按照混合物、氧化物、弱电解质和非电解质的顺序排列的一组是( )
A.淀粉、CuO、HClO、Cu
B.水玻璃、Na2O·CaO·6SiO2、Ag2O、SO3
C.KAl(SO4)2·12H2O、KClO3、NH3·H2O、CH3CH2OH
D.普通玻璃、H2O、HF、葡萄糖
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于FeCl3溶液和Fe(OH)3胶体描述正确的
A. FeCl3溶液能产生丁达尔现象,Fe(OH)3胶体不能产生丁达尔现象
B. FeCl3溶液不能产生丁达尔现象,Fe(OH)3胶体能产生丁达尔现象
C. 两者都能产生丁达尔现象
D. 两者都不能产生丁达尔现象
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知某反应的反应过程中的能量变化如图所示,下列说法正确的是( )
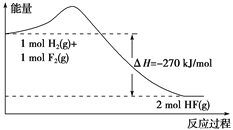
A. 热化学方程式: H2+F2===2HF,ΔH = -270 kJ/mol
B. 氟化氢气体分解生成氢气和氟气的反应是放热反应
C. 在相同条件下,1 mol H2 (g) 与1 mol F2 (g) 的能量总和大于2 mol HF (g) 的能量
D. 其他条件不变,加入催化剂,该反应的ΔH减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】据报道,我国在南海北部神狐海域进行的可燃冰(甲烷的水合物)试采获得成功。甲烷是一种重要的化工原料。
(1)甲烷重整是提高甲烷利用率的重要方式,有以下三种:
部分氧化:CH4(g)+ ![]() O2(g)
O2(g)![]() CO(g)+2H2(g) ΔH1=-35.9kJ·mol-1 ①
CO(g)+2H2(g) ΔH1=-35.9kJ·mol-1 ①
水蒸气重整:CH4(g)+H2O(g)![]() CO(g)+3H2(g) ΔH2=+205.9kJ·mol-1 ②
CO(g)+3H2(g) ΔH2=+205.9kJ·mol-1 ②
CO(g)+H2O(g)![]() CO2(g)+H2(g) ΔH3=-41.2kJ·mol-1 ③
CO2(g)+H2(g) ΔH3=-41.2kJ·mol-1 ③
二氧化碳重整:CH4(g)+CO2(g)![]() 2CO(g)+2H2(g) ΔH4 ④
2CO(g)+2H2(g) ΔH4 ④
则反应②自发进行的条件是________________,ΔH4 =_____________kJ·mol-1。
(2)起始向密闭容器中充入一定量的CH4(g)和O2(g),发生反应①。CH4(g)的平衡转化率与温度(T)和压强(P)的关系如图所示。
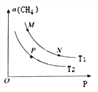
①N、P两点的平衡常数:K(N)_______K(P)(填“>”“<”或“=”),理由是_________。
②M、N两点的H2的物质的量浓度c(M)______c(N)(填“>”“<”或“=”)。
(3)合成气CO和H2在一定条件下能发生如下反应:CO(g) +2H2(g)![]() CH3OH(g)。在容积均为V L的甲、乙、丙三个密闭容器中分别充入amol CO和2a mol H2,三个容器的反应温度分别为T1、T2、T3且恒定不变,在其他条件相同的情况下,实验测得反应均进行到t min时CO的体积分数如图所示,此时三个容器中一定处在化学平衡状态的是_________(填“T1”或“T2” 或“T3”);该温度下的化学平衡常数为___________(用a、V表示)。
CH3OH(g)。在容积均为V L的甲、乙、丙三个密闭容器中分别充入amol CO和2a mol H2,三个容器的反应温度分别为T1、T2、T3且恒定不变,在其他条件相同的情况下,实验测得反应均进行到t min时CO的体积分数如图所示,此时三个容器中一定处在化学平衡状态的是_________(填“T1”或“T2” 或“T3”);该温度下的化学平衡常数为___________(用a、V表示)。

(4)光能储存一般是指将光能转换为电能或化学能进行储存,利用太阳光、CO2、H2O生成甲醇的光能储存装置如图所示,制备开始时质子交换膜两侧的溶液质量相等。则b极的电极反应式为___________________;当电路中有3mol电子转移时,质子交换膜两侧溶液相差_________g。

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com