
【题目】以CH4和 H2O为原料制备二甲醚和甲醇的工业流程如下:
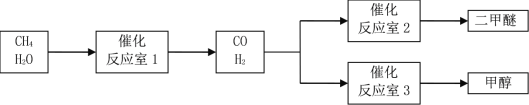
已知:2CO(g)+O2(g)=2CO2(g)△H=-566 kJ·mol-1,CH3OCH3 (g)+3O2(g)=2CO2(g)+3H2O (g) △H=-1323 kJ·mol-1,2H2(g)+O2(g)=2H2O(g)△H=-484 kJ·mol-1。
(1)反应室3中发生反应:CO(g)+2H2(g)=CH3OH(g)。该反应在一定条件下能自发进行的原因是_____。
(2)反应室2中发生反应:2CO(g)+4H2(g)=CH3OCH3(g)+H2O (g) △H=_____。
(3)反应室1中发生反应:CH4(g)+H2O (g) ![]() CO(g)+3H2(g)。对此反应进行如下研究:T℃时,向容积为2 L的密闭容器中充入一定量的CH4(g)和H2O (g)进行反应,实验测得反应过程中的部分数据见下表(表中t1<t2):
CO(g)+3H2(g)。对此反应进行如下研究:T℃时,向容积为2 L的密闭容器中充入一定量的CH4(g)和H2O (g)进行反应,实验测得反应过程中的部分数据见下表(表中t1<t2):
反应时间/min | n(CH4)/mol | n(H2O)/ mol |
0 | 1.20 | 0.60 |
t1 | 0.80 | |
t2 | 0.20 |
①反应从开始到t1分钟时的平均反应速率为v(H2)=_______mol·L-1·min-1。
②若保持其他条件不变,起始时向容器中充入0.60 mol CH4和1.20 mol H2O,反应一段时间后,测得容器中H2的物质的量为0.60 mol,则此时v正______v逆(填“>”、“<”或“=”)。
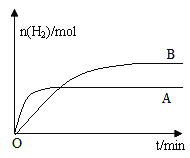
③若上述反应改变某一条件,测得H2的物质的量随时间变化见图中曲线B(A为原反应的曲线),则改变的条件可能是_________。
(4)以反应室1出来的CO和H2为燃料,一定比例Li2CO3和Na2CO3低熔混合物为电解质构成的一种碳酸盐燃料电池如右上图所示。
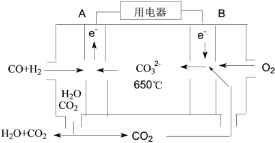
①该电池的正极反应式为_____。
②若电路中流过4 mol电子,则理论上消耗CO和H2的总体积为________L(标准状况)。
【答案】△H<0 -211kJ/mol 0.6/t1 > 减小压强或及时分离出CO O2+2CO2+4e-=2CO32- 44.8 L
【解析】
(1)CO(g)+2H2(g)=CH3OH(g)的△S<0,由一定条件下能自发进行可知△G=△H-T△S<0,则△H<0,故答案为:△H<0。
(2)根据盖斯定律,通过①+③×2-②可得反应2CO(g)+4H2(g)=CH3OCH3(g)+H2O(g)的△H=(-566kJ·mol-1)+2×(-484kJ·mol-1)-(-1323kJ·mol-1)=-211kJ/mol,故答案为:-211kJ/mol。
(3)①由于在t1分钟内v(CH4)=Δc/Δt=![]() =0.2/t1 mol·L-1·min-1,根据各物质的反应速率之比等于化学方程式中各物质的化学计量数之比可知:v(H2)=3v(CH4)=0.6/t1mol·L-1·min-1,故答案为:0.6/t1。
=0.2/t1 mol·L-1·min-1,根据各物质的反应速率之比等于化学方程式中各物质的化学计量数之比可知:v(H2)=3v(CH4)=0.6/t1mol·L-1·min-1,故答案为:0.6/t1。
②CH4和H2O按物质的量比1:1反应,充入1.2molCH4和0.6molH2O与充入0.6molCH4和1.2molH2O,平衡时生成物的浓度对应相同,t1分钟时,n(CH4)=0.8mol,n(H2O)=0.6mol-0.4mol=0.2mol,t2分钟时,n(H2O)=0.2mol,说明t1分钟时反应已经达到平衡状态。
CH4(g)+H2O(g)![]() CO(g)+3H2(g)
CO(g)+3H2(g)
起始(mol/L) 0.6 0.3 0 0
转化(mol/L) 0.2 0.2 0.2 0.6
平衡(mol/L) 0.4 0.1 0.2 0.6
平衡常数K=![]() =
=![]() =1.08
=1.08
充入0.6molCH4和1.2molH2O,反应一段时间后,测得容器中H2的物质的量为0.60mol,
CH4(g)+H2O(g)![]() CO(g)+3H2(g)
CO(g)+3H2(g)
起始(mol/L) 0.3 0.6 0 0
转化(mol/L) 0.1 0.1 0.1 0.3
一段时间后(mol/L) 0.2 0.5 0.1 0.3
Qc=![]() =
=![]() =0.027,由于K>Qc,此时向正反应方向进行,v正>v逆,故答案为:>。
=0.027,由于K>Qc,此时向正反应方向进行,v正>v逆,故答案为:>。
③根据图像可知,改变某一条件,H2的物质的量增大,达到平衡所需的时间变长,故平衡向正反应方向进行,所以可以采取减小压强或及时分离出CO的措施,故答案为:减小压强或及时分离出CO。
(4)①碳酸盐燃料电池中通氧气的电极一定为正极,通入燃料的电极一定为负极,氧气在该电极上发生还原反应,电极方程式为:2CO2+O2+4e-=2CO32-,故答案为:2CO2+O2+4e-=2CO32-。
②根据图示,碳酸盐燃料电池总的电极方程式为:H2+CO+O2=CO2+H2O,若电路中流过4mol电子,则理论上消耗CO和H2的物质的量为2mol,标准状况下总体积为2mol×22.4L/mol=44.8L,故答案为:44.8L。


科目:高中化学 来源: 题型:
【题目】以铬铁矿(含FeO·Cr2O3、Al2O3、SiO2等)为原料制备二草酸铬钾的实验步骤如图:

回答下列问题:
(1)“熔融”的装置如图,坩埚W的材质可以是___(填“铁”“陶瓷”或“玻璃”);FeO·Cr2O3与KClO3及Na2CO3发生反应,生成Fe2O3、KCl、Na2CrO4和CO2的化学方程式为____。

(2)熔融后的固体中含Na2CrO4、Fe2O3、Na2SiO3、NaAlO2、KCl及NaFeO2等,步骤①的具体步骤为水浸,过滤,调pH为7~8,加热煮沸半小时,趁热过滤。第一次过滤滤渣中的主要成分为_____。
(3)步骤②需加入酸,则加入稀硫酸时发生反应的离子方程式为____。
(4)由步骤③可知,溶解度:Na2Cr2O7____(填“>”“<”或“══”)K2Cr2O7。
(5)步骤④包含的具体操作有___、___过滤并洗涤,经干燥得到K2Cr2O7晶体。(有关物质的溶解度曲线如图所示)

(6)步骤⑤需往两种固体混合物中加入一滴水及少量酒精研磨,所用的硅酸盐质仪器的名称是____。
(7)采用热重分析法测定K[Cr(C2O4)2]·nH2O样品所含结晶水数,将样品加热到80°C时,失掉全部结晶水,失重16.8%。K[Cr(C2O4)2]·nH2O晶体中n=____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】砷化镍可用于制作发光器件、半导体激光器、太阳能电池和高速集成电路。
(1)基态Ni原子的价电子排布式为 ___,基态As原子电子占据最高能级的电子云轮廓图为 __ 形。
(2)第一电离能As ___Se(填“>”或“<”) ,原因是____。As2O3(砒霜)是两性氧化物,As2O3溶于盐酸生成AsCl3,AsCl3用LiAlH4还原生成AsH3。
(3)①AlH4-的中心原子的杂化方式为___,其空间构型为____,写出一种与AlH4-互为等电子体的分子的化学式___。
②AsH3分子中H—As—H键角__109.5°(填“>”、“=”或“<”)。AsH3沸点低于NH3,其原因是____。
(4)有机砷![]() 是治疗昏睡病不可缺少的药物,该有机砷中存在的化学键的种类为____(填字母编号)。
是治疗昏睡病不可缺少的药物,该有机砷中存在的化学键的种类为____(填字母编号)。
a.离子键 b.σ键 c.π键 d.碳碳双键
(5)砷化镍激光在医学上用于治疗皮肤及粘膜创面的感染、溃疡等,砷化镍晶胞如图所示,该晶胞密度ρ为____g·cm-3(列式即可,不必化简)。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某盐酸试剂瓶上的标签如图所示。下列有关说法正确的是(设NA表示阿伏加德罗常数的值( )
盐酸
分析纯(AR)
体积:500ml
化学式:HCl
相对分子质量:36.5
质量分数:36.5%
密度:1.19g.ml-1
A.该浓度的盐酸可用广口瓶盛装
B.该盐酸的物质的量浓度为1.19g.ml-1
C.用该盐酸配制250ml2.0mol/L的稀盐酸时需选用100ml的量筒
D.该盐酸中所含Cl-的数目为5.95NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】标准状况下,V L氯化氢(HCl)溶解在1 L水中(水的密度近似为1 g/mL)所得溶液的密度为ρ g/mL,质量分数为w,物质的量浓度为c mol/L,则下列关系中不正确的是( )
A. w=36.5c/1000ρ B. c=1000ρw/36.5
C. c=Vρ/(36.5V+22400) D. w=36.5V/(36.5V+22400)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某无色溶液中可能含有Na+、Ba2+、Cu2+、CO32-、Cl-、Mg2+中的一种或几种离子。
①向此溶液中滴加足量稀盐酸无明显现象。
②取少许①的溶液并加入少量的Na2SO4溶液,有白色沉淀产生。
③取②的上层清液并加入足量的NaOH溶液,有白色沉淀产生。
(1)原溶液中一定含有的离子是________,一定不含有的离子是________,不能确定是否含有的离子是________。
(2)②中反应的离子方程式为___________________。
(3)若另取10mL①的溶液于锥形瓶中,然后向此溶液中逐滴加入NaOH溶液(如图甲所示)。滴加过程中产生沉淀的质量与加入NaOH溶液的体积的关系如图乙所示。
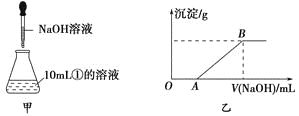
①OA段反应的离子方程式为_____________________。
②AB段反应的离子方程式为_______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将2.80g含氧化镁的镁条完全溶于50.0mL硫酸溶液后,滴加2.00mol·Lˉ1氢氧化钠溶液,恰好完全沉淀时用去氢氧化钠溶液200.0mL。将所得的沉淀灼烧、冷却后称量得固体质量为4.40g。
已知:Mg(OH)2在灼烧过程中发生如下反应Mg(OH)2![]() MgO+H2O
MgO+H2O
请计算:
(1)用去的氢氧化钠溶液中含溶质的物质的量n(NaOH)=_______mol。(结果保留小数点后两位有效数字)
(2)镁条中氧化镁和镁的物质的量之比为n(MgO)︰n(Mg)=________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com