
分析 溶液中c(OH-)=10-10mol/L,代入Ksp[Cu(OH)2]计算溶液中c(Cu2+),再将c(Cu2+)代入Ksp(CuS)计算溶液中c( S2-).
解答 解:反应后测得溶液的pH=4,则溶液中c(OH-)=10-10mol/L,根据Ksp=c(Cu2+)×c2(OH-)=2.2×10-20,可得c(Cu2+)=$\frac{2.2×1{0}^{-20}}{(1{0}^{-10})^{2}}$mol/L=2.2mol/L,由Ksp=c(Cu2+)c(S2-)=8.8×10-36,可得此时溶液中c( S2-)=$\frac{8.8×1{0}^{-36}}{2.2}$mol/L=4.0×10-36mol/L,故答案为:4.0×10-36 .
点评 本题是实溶度积有关计算,是对基础知识的综合应用,题目难度中等.


 学练快车道口算心算速算天天练系列答案
学练快车道口算心算速算天天练系列答案科目:高中化学 来源: 题型:解答题
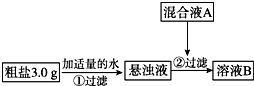 目前国内外使用的融雪剂一般有两大类:一类是以醋酸钾为主要成分的有机融雪剂;另一类是以“氯盐”为主要成分的无机融雪剂,如氯化钠、氯化钙、氯化镁等,通称“化冰盐”.某研究性学习小组拟对融雪氯盐(如图称为粗盐)(主要含有氯化钠及不溶性杂质、Mg2+、Ca2+等)进行回收提纯研究.
目前国内外使用的融雪剂一般有两大类:一类是以醋酸钾为主要成分的有机融雪剂;另一类是以“氯盐”为主要成分的无机融雪剂,如氯化钠、氯化钙、氯化镁等,通称“化冰盐”.某研究性学习小组拟对融雪氯盐(如图称为粗盐)(主要含有氯化钠及不溶性杂质、Mg2+、Ca2+等)进行回收提纯研究.| 化学式 | CaCO3 | CaSO3 | CaC2O4 | Mg(OH)2 |
| Ksp | 2.8×10-9 | 6.8×10-8 | 4.0×10-9 | 1.8×10-11 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 钠与CuSO4溶液反应:2Na+Cu=Cu↓+2Na+ | |
| B. | 明矾溶于水产生Al(OH)3胶体:Al3++3H2O═Al(OH)3↓+3H+ | |
| C. | Na2O2溶于水产生O2:Na2O2+H2O═2Na++2OH-+O2↑ | |
| D. | Ca(HCO3)2溶液与少量NaOH溶液反应:HCO3-+Ca2++OH-═CaCO3↓+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 负极反应为:14H2O+7O2+28e-=28OH- | |
| B. | 放电一段时间后,负极周围的pH升高 | |
| C. | 放电过程中OH-向正极移动 | |
| D. | 每消耗1mol C2H6,则电路上转移的电子为14mol |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 过渡元素全部都是副族元素 | |
| B. | 短周期共有32 种元素 | |
| C. | 科学研究时,经常在过渡元素中寻找耐高温、耐腐蚀的合金材料 | |
| D. | 元素周期表共七个横行代表七个周期,18 个纵横代表18 个族 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
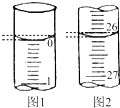 某学生用已知物质的量浓度的盐酸来测定未知物质的量浓度的氢氧化钠溶液(盛放于锥形瓶中)时,选择酚酞作指示剂,请填写下列空白:
某学生用已知物质的量浓度的盐酸来测定未知物质的量浓度的氢氧化钠溶液(盛放于锥形瓶中)时,选择酚酞作指示剂,请填写下列空白:| 滴定次数 | 0.1000mol-L-1盐酸的体积/mL | ||
| 滴定前 | 滴定后 | 体积/mL | |
| 1 | 0.10 | 26.21 | 26.11 |
| 2 | 1.56 | 31.30 | 29.74 |
| 3 | 0.22 | 26.31 | 26.09 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 分子式为C5H10的烯烃 | B. | 分子式为C4H8O2的酯 | ||
| C. | 甲苯(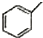 )的一氯代物 )的一氯代物 | D. | 立体烷( 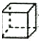 )的二氯代物 )的二氯代物 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com