
| A. | 某无色溶液中可能大量存在H+、Cl-、MnO4- | |
| B. | pH=2的溶液中可能大量存在Na+、NH4+、SiO32- | |
| C. | Fe2+与H2O2在酸性溶液中的反应:2Fe2++H2 O2+2H+═2Fe3++2H2O | |
| D. | 稀硫酸与Ba(OH)2溶液的反应:H++SO42-+Ba2++OH-═BaSO4↓+2H2O |
分析 A.无色溶液中不能存在有颜色的离子;
B.pH=2的溶液呈酸性,弱酸的酸根离子不能大量存在;
C.Fe2+与H2O2在酸性溶液中发生氧化还原反应,生成铁离子和水;
D.离子的配比数不符合反应的实际.
解答 解:A.MnO4-是紫色,不可能存在无色溶液中,故A错误;
B.pH=2的溶液呈酸性,硅酸根离子和氢离子反应生成硅酸沉淀,故B错误;
C.Fe2+与H2O2在酸性溶液中发生氧化还原反应,生成铁离子和水,反应的离子方程式2Fe2++H2 O2+2H+═2Fe3++2H2O满足电子守恒和电荷守恒,故C正确;
D.氢离子和硫酸根离子比例应为2:1,应为2H++SO42-+Ba2++2OH-═BaSO4↓+2H2O,故D错误.
故选C.
点评 本题综合考查离子共存以及离子方程式的正误判断,为高频考点,侧重于学生的分析以及元素化合物知识的综合理解和运用的考查,注意把握物质的性质以及离子的性质,难度不大.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:选择题
| 事实 | 现象 | 解释 | |
| A | 氯化铁溶液中滴加少量氢硫酸 | 产生黄色浑浊 | 2Fe3++H2S=2Fe2++S↓+2H+ |
| B | Fe(NO3)2溶液加稀盐酸 | 溶液绿色加深 | Fe2++H2O?Fe(OH)2+2H+ 抑制了水解,浅绿色加深 |
| C | 已知CH4的燃烧热为890kJ/mol | 甲烷用作燃料,1.6g CH4完全燃烧,放热89kJ | CH4(g)+2O2(g)=CO2(g)+2H2O(g) △H=-890kJ/mol |
| D | Mg(OH)2悬浊液中滴加FeCl3溶液至Mg(OH)2几乎完全反应 | 白色沉淀变为红褐色沉淀 | $\frac{{k}_{sp}^{3}[Mg(OH)_{2}]}{{k}_{sp}^{2}[Fe(OH]_{3}]}$<105 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Al3+、SO42-、NH3•H2O | B. | Na+、OH-、Cl2 | ||
| C. | K+、Ca2+、CO32- | D. | H+、Na+、NO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 异丙苯的分子式为C9H12 | |
| B. | 异丙苯的沸点比苯高 | |
| C. | 异丙苯中碳原子可能都处于同一平面 | |
| D. | 异丙苯和苯为同系物 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
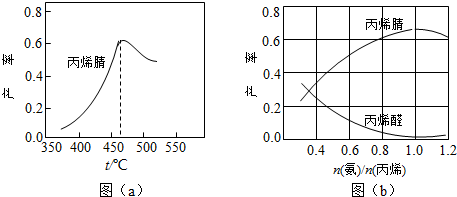
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| 物质 | V2O5 | V2O4 | K2SO4 | SiO2 | Fe2O3 | Al2O3 |
| 质量分数/% | 2.2~2.9 | 2.8~3.1 | 22~28 | 60~65 | 1~2 | <1 |
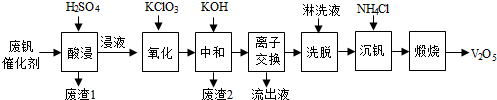
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 使用催化剂能够降低化学反应的反应热(△H) | |
| B. | 金属发生吸氧腐蚀时,被腐蚀的速率与氧气浓度无关 | |
| C. | 原电池中发生的反应达平衡时,该电池仍有电流产生 | |
| D. | 在同浓度的盐酸中,ZnS可溶而CuS不溶,说明CuS的溶解度比ZnS的小 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com