
【题目】已知磷酸分子(![]() )中的三个氢原子都可以与重水分子(D2O)中的 D 原子发生氢交换。又知次磷酸( H3 PO2)也可与 D2O 进行氢交换,但次磷酸钠(NaH2PO2)却不能与 D2O 发生氢交换。下列说法正确的是
)中的三个氢原子都可以与重水分子(D2O)中的 D 原子发生氢交换。又知次磷酸( H3 PO2)也可与 D2O 进行氢交换,但次磷酸钠(NaH2PO2)却不能与 D2O 发生氢交换。下列说法正确的是
A.H3 PO2 属于三元酸B.NaH2PO2 溶液可能呈酸性
C.NaH2PO2 属于酸式盐D.H3 PO2 的结构式为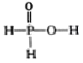
【答案】D
【解析】
根据磷酸分子中的三个氢原子都可以跟重水分子(D2O)中的D原子发生氢交换及次磷酸(H3PO2)也可跟D2O进行氢交换,说明羟基上的氢能与D2O进行氢交换,但次磷酸钠(NaH2PO2)却不能跟D2O发生氢交换,说明次磷酸钠中没有羟基氢,则H3PO2中只有一个羟基氢,据此分析解答。
A. 根据以上分析,H3PO2中只有一个羟基氢,则H3PO2属于一元酸,故A错误;
B. NaH2PO2属于正盐并且为强碱形成的正盐,所以溶液不可能呈酸性,故B错误;
C. 根据以上分析,H3PO2中只有一个羟基氢,则H3PO2属于一元酸,所以NaH2PO2属于正盐,故C错误;
D. 根据以上分析,H3PO2中只有一个羟基氢,结构式为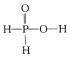 ,故D正确;
,故D正确;
故选:D。


科目:高中化学 来源: 题型:
【题目】香豆素(结构如图中I所示)是用途广泛的香料,由香豆素经下列图示的步骤可转变为水杨酸。
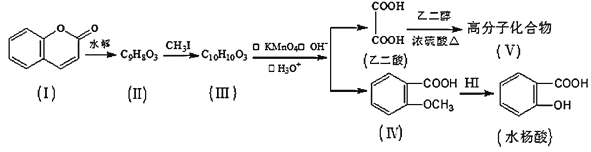
已知:CH3CH=CHCH2CH3![]() CH3COOH+CH3CH2COOH
CH3COOH+CH3CH2COOH
请回答下列问题:
(1)香豆素分子中的官能团的名称为__,步骤Ⅱ→Ⅲ的反应类型为__。
(2)有机物III的结构简式为__,在上述转化过程中,设计反应步骤II→III的目的是__。
(3)下列关于有机物Ⅰ、Ⅱ、Ⅲ、Ⅳ的叙述中正确的是__(选填序号)。
A.可用FeCl3溶液来鉴别II和III
B.Ⅳ中核磁共振氢谱共有4种峰
C.Ⅰ、Ⅱ、Ⅲ均可使溴的四氯化碳溶液褪色
D.1molⅡ最多能和2molNaHCO3发生反应
(4)香豆素在过量NaOH溶液中完全水解的化学方程式为__。
(5)写出乙二酸和乙二醇(HOCH2CH2OH)生成Ⅴ的化学方程式为__。
(6)化合物Ⅳ有多种同分异构体,符合下列两个条件的芳香族同分异构体共有__种。
①遇FeCl3溶液发生显色反应;
②能发生水解反应和银镜反应。
其中,核磁共振氢谱共有5种吸收峰,且吸收峰面积比为1∶2∶2∶2∶1同分异构体的结构简式为__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】麻黄素M是拟交感神经药。合成M的一种路线如图所示:
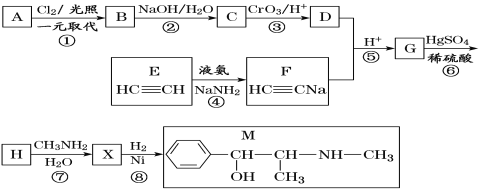
已知:I.R—CH2OH![]() RCHO
RCHO
II.R1-CHO+R-C≡CNa![]()
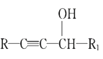
IV.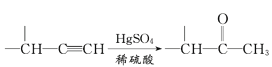
V.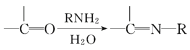
请回答下列问题:
(1)D的名称是_______;G中含氧官能团的名称是_______。
(2)反应②的反应类型为_______;A的结构简式为_______。
(3)写出反应⑦的化学方程式:______________________________。
(4)X分子中最多有_______个碳原子共平面。
(5)在H的同分异构体中,同时能发生水解反应和银镜反应的芳香族化合物中,核磁共振氢谱上有4组峰,且峰面积之比为1∶1∶2∶6的有机物的结构简式为_________________。
(6)已知:![]() 仿照上述流程,设计以苯、乙醛为主要原料合成某药物中间体
仿照上述流程,设计以苯、乙醛为主要原料合成某药物中间体![]() 的路线________________。
的路线________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】固定容积为2 L的密闭容器中发生反应xA(g)+yB(g)![]() zC(g),图1表示T ℃时容器中各物质的量随时间变化的关系,图2表示平衡常数K随温度变化的关系。结合图像判断,下列结论正确的是
zC(g),图1表示T ℃时容器中各物质的量随时间变化的关系,图2表示平衡常数K随温度变化的关系。结合图像判断,下列结论正确的是
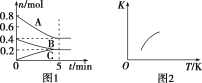
A.该反应可表示为2A(g)+B(g)![]() C(g) ΔH<0
C(g) ΔH<0
B.T ℃时该反应的平衡常数K=6.25
C.当容器中气体密度不再变化时,该反应达到平衡状态
D.T ℃,在第6 min时再向体系中充入0.4 mol C,再次达到平衡时C的体积分数大于0.25
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】连二次硝酸(H2N2O2)是一种二元酸,可用于制N2O气体。
(1)连二次硝酸中氮元素的化合价为_____________________。
(2)常温下,用0.01mol·L-1的NaOH溶液滴定10mL0.01mol·L-1的H2N2O2溶液,测得溶液pH与NaOH溶液体积的关系如图所示。
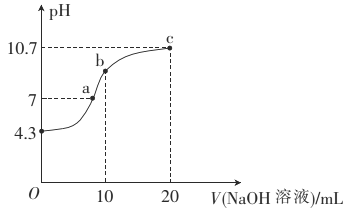
①写出H2N2O2在水溶液中的电离方程式:______________。
②b点时溶液中c(H2N2O2)_____(填“>”、“<”或 “=”,下同)c(N2O22-)。
③a点时溶液中c(Na+)____c(HN2O2-)+c(N2O22-)。
(3)硝酸银溶液和连二次硝酸钠溶液混合,可以得到黄色的连二次硝酸银沉淀,向该分散系中滴加硫酸钠溶液,当白色沉淀和黄色沉淀共存时,分散系中![]() =______。[已知Ksp(Ag2N2O2)=4.2×10-9,Ksp(Ag2SO4)=1.4×10-5]
=______。[已知Ksp(Ag2N2O2)=4.2×10-9,Ksp(Ag2SO4)=1.4×10-5]
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室用 NH4Cl、盐酸、NaClO2 为原料制备 ClO2 的过程如下图所示,下列说法不正确的是
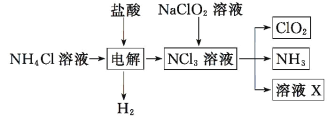
A.X 中大量存在的阴离子有 Cl-和 OH-B.NCl3 的键角比 CH4 的键角大
C.NaClO2 变成 ClO2 发生了氧化反应D.制取 3 mol ClO2 至少需要 0.5mol NH4Cl
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】类比pH的定义,对于稀溶液可以定义pC=-lgC,pKa=-lgKa,常温下,某浓度H2A溶液在不同pH值下,测得pC(H2A)、pC(HA﹣)、pC(A2﹣)变化如图所示,下列说法正确的是
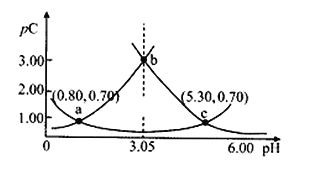
A.随着pH的增大,pC增大的曲线是A2﹣的物质的量浓度的负对数
B.pH=3.50时,c(HA﹣)> c(H2A) > c(A2﹣)
C.b点时c(H2A)·c(A2﹣)/c2(HA﹣)=10﹣4.5
D.pH=3.00~5.30时,c(H2A)+c(HA﹣)+c(A2﹣)先减小后增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是一套电化学装置,对其有关说法错误的是( )
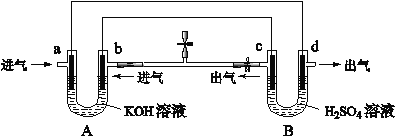
A.装置A是原电池,装置B是电解池
B.反应一段时间后,装置B中溶液pH增大
C.a若消耗1mol CH4,d可产生4mol气体
D.a通入C2H6时的电极反应为 C2H6-14e-+ 18OH-= 2CO32-+ 12H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)已知H2S的燃烧热ΔH=-akJ·mol-1,写出表示H2S燃烧反应的热化学方程式__,表示H2S燃烧热的热化学方程式__。
(2)若将FeCl3溶液蒸干灼烧,最后得到的固体产物主要是__(填化学式)。FeCl3水溶液呈__(填“酸”、“中”、“碱”)性,原因为:__(用离子方程式表示)。
(3)炒过菜的铁锅未及时洗净(残液中有NaCl),第二天便会被腐蚀而出现红褐色铁锈,试回答:铁锅的腐蚀属于电化腐蚀,其原因是__。此时铁锅锈蚀主要是吸氧腐蚀,电极反应方程式为:负极:__,正极__。
(4)估计下列各变化过程是熵增加还是熵减小。(用A、B、C填空)
NH4NO3爆炸:2NH4NO3(s)=2N2(g)+4H2O(g)+O2(g)__
水煤气转化:CO(g)+H2O(g)=CO2(g)+H2(g)__
臭氧的生成:3O2(g)=2O3(g)__
A.熵增大 B.熵减小 C.熵变很小
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com