
����Ŀ����֪��25����1.013��105Pa��,1mol������ȫȼ������Һ̬ˮ�ų�285kJ������,��ش���������:
(1)�����������ܺ�__________(��"����""С��"��"����")��Ӧ�������ܺ�
(2)��2mol������ȫȼ������ˮ����,��ų�������__________(��">""<"��"=")570kJ��
(3)����25��C��1.013��105Pa�µ�H2��CH4�Ļ������0.5mol,��ȫȼ������һ��������CO2�����10.8g H2O(l),�ų�203kJ������,��1mol CH4��ȫȼ������CO2�����H2O(l)�ų�������Ϊ__________kJ��
(4)��������������ɴ���ʹ����һ�����͵��װ��,�乹����ͼ��ʾ,A��B�����缫���ɶ��̿����ɡ��õ�ص�������ӦʽΪ:__________

���õ�ع���ʱ������1mol H2O,��·��ת�Ƶ��ӵ����ʵ���Ϊ__________
(5)���������װ����ͨ��������ij�CH4����,Ҳ�������һ��ԭ���װ��,��ص��ܷ�Ӧ����ʽΪ:CH4+2O2+2KOH==K2CO3+3H2O,��õ�صĸ�����ӦʽΪ:__________
���𰸡�С�� < 890 H2+2H2O+4e-=4OH- 2mol CH4+10OH--8e-=CO32-+7H2O
��������
��1����Ӧ���뷴Ӧ����������������йأ���Ӧ����������������������������Ӧ���ȣ���֮���ȣ�
��2�����ʵľۼ�״̬��ͬ����Ӧ�Ȳ�ͬ����̬���ʱ�ΪҺ̬���ʷ��ȣ���֮���ȣ�
��3�����������ķ�Ӧ�Ⱥ����������ʵ������������غ���㣻
��4����������ȼ�ϵ���У�ͨ��������һ��Ϊԭ��صĸ���������������Ӧ��ͨ��������һ��Ϊԭ��ص�������������ԭ��Ӧ�����ݷ�Ӧ���ܷ�Ӧʽ����ת�Ƶ��ӵ����ʵ�����
��5��ͨ������һ��Ϊԭ��صĸ���������������Ӧ�������ܷ�Ӧʽ�жϡ�
��1����Ӧ���ȣ����������������С�ڷ�Ӧ������������ʴ�Ϊ��С�ڡ�
��2��2mol������ȫȼ������Һ̬ˮ�ų�570kJ����������Һ̬ˮ��Ϊ��̬ˮҪ���ȣ���2mol������ȫȼ������ˮ��������ų�������С��570kJ���ʴ�Ϊ������
��3�����������к���xmolCH4����H2�����ʵ���Ϊ��0.5-x��mol����1molCH4��ȫȼ������CO2�����H2O��l���ų�������ΪQkJ��
���У�xQ+(0.5-x)��285��203(�����غ�)��2x+(0.5-x)��10.8(�����غ�)
��֮�ã�x=0.1��Q=890��
�ʴ�Ϊ��890��
��4����������ȼ�ϵ���У�ͨ��������һ��Ϊԭ��صĸ���������������Ӧ���缫��ӦʽΪH2-2e-+OH-=2H2O��ͨ��������һ��Ϊԭ��ص�������������ԭ��Ӧ���缫��ӦʽΪO2+4e-+2H2O=4OH-���ܷ�ӦʽΪO2+2H2=2H2O������1molH2Oʱ����0.5mol O2�μӷ�Ӧ��ת�Ƶ��ӵ����ʵ���Ϊ2mol���ʴ�Ϊ��O2+2H2O+4e-=4OH-��2mol��
��5�������ܷ�Ӧʽ��֪��ͨ������һ��Ϊԭ��صĸ���������������Ӧ���缫��ӦʽΪCH4+10OH--8e-=CO32-+7H2O���ʴ�Ϊ��CH4+10OH--8e-=CO32-+7H2O��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������18.4 mol��L-1��Ũ����������500mL 0.5 mol��L-1��ϡ���ᣬ�ɹ�ѡ��������У��������� ���ձ� ����ͷ�ι� ����Ͳ ��������ƽ
��1���������������ƹ����в���Ҫ�õ�����__________________��������ţ������������⣬��ȱ����Ҫ��������_____________________ ��
��2����������Ũ��������Ϊ___________m L������1λС������
��3��ʵ�����õ��������������÷ֱ��ǣ�___________��__________��
��4������ʱ��һ��ɷ�Ϊ���¼������裺
����ȡ ������ ��ϡ�� ��ҡ�� ��ת�� ��ϴ�� ������ ����ȴ������ȷ�IJ���˳�� Ϊ���ڡ��١��ۡ�____ ��____��____��____����������ţ� ____________
��5�������ƹ����У����в���������������ҺŨ��ƫ�͵���____________������ţ�
������ʱ�����ӿ̶��ߡ�
��δ��ȴ�����¾�ת�Ƶ�����ƿ�С�
������ƿ�к�����������ˮ��
��δϴ��ϡ��Ũ����ʱ�ù����ձ��Ͳ�������
������ҡ�Ⱥ���Һ����ڿ̶��ߣ����ý�ͷ�ιܼ�����ˮ���̶��ߡ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����16.8g̼��������11.7g�������ƹ����Ϻ����ܱ������м��ȳ�ַ�Ӧ���ų��������ʺ���ȴ���õ��������X��
��1��д��̼�����Ʒֽ����������ֱ���������Ʒ�Ӧ�Ļ�ѧ��Ӧ����ʽ��
_________________��_________________________��
��2���������X�ijɷ���____________��
A��Na2O2��NaOH B��Na2O2��Na2CO3 C��NaOH��Na2CO3 D��Na2O2��NaOH��Na2CO3
��3�������X����μ���1mol/L��ϡ���������ٲ�������Ϊֹ�������������ڱ�״���µ����Ϊ____L������V(HCl)Ϊ�����꣬V(CO2)Ϊ�����꣬��������CO2������ͼ���ϡ������Һ����Ĺ�ϵ��
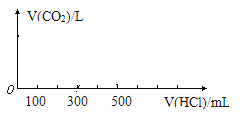
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ʵ��������1mol/L 250mL NaCl��Һ�����������в���Ҫ����
A.������B.��Һ©��C.��ͷ�ι�D.250mL����ƿ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ѧ��Ӧ���ʺ���������������������ء�
(1)ijѧ��Ϊ��̽��п�����ᷴӦ�����е����ʱ仯,��400mLϡ�����м���������п��,����ˮ�������ռ���Ӧ�ų�������,ʵ���¼���(�ۼ�ֵ):
ʱ��(min) | 1 | 2 | 3 | 4 | 5 |
�������(mL)(��״��) | 100 | 240 | 464 | 576 | 620 |
����һʱ��η�Ӧ�������__________min(��0~1��1~2��2~3��3~4��4~5),ԭ����__________��
����3~4����ʱ����������Ũ�ȱ仯����ʾ�ĸ÷�Ӧ����__________(����Һ�������)��
(2)��һѧ��Ϊ���Ʒ�Ӧ���ʷ�ֹ��Ӧ�������Բ����������,�������������м���������������Һ�Լ�����Ӧ����,����Ϊ�����е�����_________��
A.����ˮ B.KCl��Һ C.KNO3��Һ D.CuSO4��Һ
(3)ij�¶�����4L�ܱ�������,X��Y��Z������̬���ʵ����ʵ�����ʱ��仯������ͼ
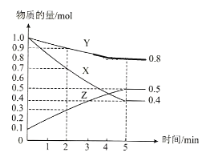
���÷�Ӧ�Ļ�ѧ����ʽ��__________��
���÷�Ӧ�ﵽƽ��״̬�ı�־��__________��
A X��Y��Z�ķ�Ӧ�������
B X��Y�ķ�Ӧ���ʱ�Ϊ3:1
C ����������ѹǿ���ֲ���
D ����1mol Y��ͬʱ����2mol Z
��2min��X��ת����Ϊ__________��
����������Ӧ��X��Y��Z�ֱ�ΪH2��N2��NH3,����֪17g�����ֽ�ɵ���������Ҫ����46kJ����,��÷�Ӧ���Ȼ�ѧ��Ӧ����ʽΪ:__________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����б���ʽ�������
A. ����ĵ���ʽ��![]()
B. ̼ԭ�ӵ�L����ӹ����ʾʽ��![]()
C. �����ӵĺ�������Ų�ʽ��1s22s22p63s23p6
D. ̼��12ԭ�ӣ�![]()
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ȷ��ʾ���з�Ӧ�����ӷ���ʽ��
A. NaNO2��Һ�м�������KMnO4��Һ��2MnO4��+5NO2��+6H+�T2Mn2++5NO3��+3H2O
B. ̼�������Һ�м�����������������Һ��NH4++HCO3��+2OH���TCO32��+NH3H2O+H2O
C. Fe��NO3��3��Һ�м��������HI��Һ��2Fe3++2I���T2Fe2++I2
D. �ö��Ե缫��������Ȼ��ƣ�2Cl��+2H2O�TCl2��+H2��+2OH��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ָ����Ӧ�����ӷ���ʽ��ȷ����
A. ����Na2CO3��Һ��CaSO4���巴Ӧ��CO32+CaSO4![]() CaCO3+SO42
CaCO3+SO42
B. �ữNaIO3��NaI�Ļ����Һ��I +IO3+6H+![]() I2+3H2O
I2+3H2O
C. KClO������Һ��Fe(OH)3��Ӧ��3ClO+2Fe(OH)3![]() 2FeO42+3Cl+4H++H2O
2FeO42+3Cl+4H++H2O
D. ��ⱥ��ʳ��ˮ��2Cl+2H+![]() Cl2��+ H2��
Cl2��+ H2��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������Һ�У�������Ũ�������ǣ� ��
A.1L 1mol/L NaCl��ҺB.2L 1mol/L KCl��Һ
C.3L 1mol/L AlCl3��ҺD.1L 2mol/L NaCl��Һ
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com