
| A. | 二氧化碳的结构式:O=C=O | B. | 氯离子的结构示意图: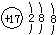 | ||
| C. | 钙离子的电子式:Ca2+ | D. | 溴化氢分子的电子式: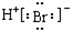 |
分析 A.二氧化碳分子中含有两个碳氧双键,为直线型结构;
B.氯离子的核电荷数为17,核外电子总数为18,最外层达到8电子稳定结构;
C.钙离子为阳离子,用离子符号表示其电子式;
D.溴化氢为共价化合物,分子中不存在阴阳离子.
解答 解:A.二氧化碳为直线型结构,分子中含有两个碳氧双键,其结构式为:O=C=O,故A正确;
B.氯离子的核电荷数为17,最外层满足8电子稳定结构,其离子结构示意图为: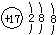 ,故B正确;
,故B正确;
C.钙离子为阳离子,直接用离子符号表示其电子式,钙离子的电子式为Ca2+,故C正确;
D.溴化氢属于共价化合物,分子中不存在阴阳离子,溴化氢正确的电子式为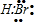 ,故D错误;
,故D错误;
故选D.
点评 本题考查了常见化学用语的表示方法,题目难度中等,涉及电子式、结构式、离子结构示意图等知识,明确常见化学用语的书写原则为解答关键,试题侧重考查学生的规范答题能力.


 桃李文化快乐暑假武汉出版社系列答案
桃李文化快乐暑假武汉出版社系列答案 优秀生快乐假期每一天全新寒假作业本系列答案
优秀生快乐假期每一天全新寒假作业本系列答案 暑假接力赛新疆青少年出版社系列答案
暑假接力赛新疆青少年出版社系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
| A | B | C | D | E | F | |
| A | ↑↓ | - | - | ↓ | - | |
| B | ↑↓ | ↓ | - | ↓ | ↓ | |
| C | - | ↓ | - | - | ↓ | |
| D | - | - | - | ↓ | - | |
| E | ↓ | ↓ | - | ↓ | ↓ | |
| F | - | ↓ | ↓ | - | ↓ |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
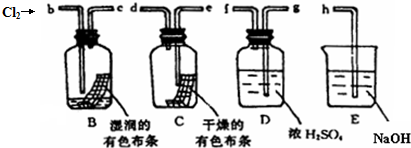
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NaCl(Na2CO3) | B. | Fe(Cu) | C. | Na2CO3(CaCO3) | D. | HCl(BaCl2) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| T/K | 2.98 | 398 | 498 |
| 平衡常数K | 2.44×10-6 | K1 | K2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向铜和稀硫酸的混合物中加入无色溶液,溶液逐渐变成蓝色,铜逐渐溶解,则该无色溶液一定是硝酸 | |
| B. | 用蘸有浓氨水的玻璃棒置于某无机酸浓溶液的试剂瓶口,有大量白烟,说明该无机酸一定为盐酸 | |
| C. | SO2气体通入Ba(NO3)2溶液中,溶液出现浑浊现象,说明有BaSO3沉淀生成 | |
| D. | 向NaHCO3溶液中滴加酚酞试液,加热时溶液由淡红色变为红色,冷却后溶液由红色变为淡红色,说明HCO3-在水溶液中存在水解平衡 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | H2在负极发生氧化反应 | B. | 燃料电池的能量转化率可达100% | ||
| C. | 是一种高效、环境友好的发电装置 | D. | 供电时的总反应为:2H2+O2=2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com