
| A. | 氯气与水反应:Cl2+H2O═Cl-+2H++ClO- | |
| B. | 氨气通入醋酸溶液中:NH3+H+═NH4+ | |
| C. | 制备Fe(OH)3胶体:Fe3++3H2O $\frac{\underline{\;\;△\;\;}}{\;}$ Fe(OH)3(胶体)+3H+ | |
| D. | 碳酸氢钠溶液中加入过量石灰水:HCO3-+OH-═CO32-+H2O |
分析 A.次氯酸为弱酸,离子方程式中次氯酸不能拆开;
B.醋酸为弱酸,离子方程式中醋酸不能拆开;
C.将氯化铁饱和溶液加入沸水中加热可获得氢氧化铁胶体;
D.石灰水过量,反应生成碳酸钙沉淀、氢氧化钠和水.
解答 解:A.氯气与水反应生成氯化氢和次氯酸,正确的离子方程式为:Cl2+H2O═Cl-+H++HClO,故A错误;
B.氨气通入醋酸溶液中,醋酸不能拆开,正确的离子方程式为:NH3+CH3COOH═CH3COO-+NH4+,故B错误;
C.制备Fe(OH)3胶体的离子方程式为:Fe3++3H2O $\frac{\underline{\;\;△\;\;}}{\;}$ Fe(OH)3(胶体)+3H+,故C正确;
D.碳酸氢钠与过量氢氧化钙溶液反应生成碳酸钙、氢氧化钠和水,正确的离子方程式为:Ca2++HCO3-+OH-=CaCO3↓+H2O,故D错误;
故选C.
点评 本题考查了离子方程式的书写判断,题目难度中等,明确离子方程式的书写原则为解答关键,注意掌握需要保留化学式的物质,如难溶物、弱电解质、氧化物、气体等,试题培养了学生的灵活应用能力.


科目:高中化学 来源: 题型:选择题
| A. | 实验室制氢气,为了加快反应速率,可向稀H2SO4中滴加少量Cu(NO3)2溶液 | |
| B. | 反应A(g)?2B(g);若正反应的活化能为Ea kJ•mol-1,逆反应的活化能为Eb kJ•mol-1,则该反应的△H=(Ea-Eb)kJ•mol-1 | |
| C. | N2(g)+3H2(g)?2NH3(g)△H<0,其他条件不变时升高温度,平衡时氢气转化率增大 | |
| D. | 吸热反应“TiO2(s)+2Cl2(g)=TiCl4(g)+O2(g)”在一定条件下可自发进行,则该反应的△S<0 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CH3COOH(l) | B. | CH3COOH(g) | C. | CO(g) | D. | CO2(g) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 Na2S2O3俗称大苏打(海波)是重要的化工原料.用Na2SO3和硫粉在水溶液中加热反应,可以制得Na2S2O3.已知10℃和70℃时,Na2S2O3在100g水中的溶解度分别为60,.0g和212g.常温下,从溶液中析出的晶体是Na2S2O3•5H2O.现实验室欲制取Na2S2O3•5H2O晶体(Na2S2O3•5H2O的分子量为248)步骤如下:
Na2S2O3俗称大苏打(海波)是重要的化工原料.用Na2SO3和硫粉在水溶液中加热反应,可以制得Na2S2O3.已知10℃和70℃时,Na2S2O3在100g水中的溶解度分别为60,.0g和212g.常温下,从溶液中析出的晶体是Na2S2O3•5H2O.现实验室欲制取Na2S2O3•5H2O晶体(Na2S2O3•5H2O的分子量为248)步骤如下:| 滴定次数 | 滴定前读数(mL) | 滴定滴定后读数(mL) |
| 第一次 | 0.30 | 31.12 |
| 第二次 | 0.36 | 31.56 |
| 第三次 | 1.10 | 31.88 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 甲、丙两液体均可产生丁达尔现象 | |
| B. | 乙中产生的气泡能使BaCl2溶液变浑浊 | |
| C. | 若忽略溶液体积的变化,则烧杯中c(Cl-)不变 | |
| D. | 若将CaC03换成CaS04,也可得到相同的实验现象 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
 一定条件下存在反应C(s)+H2O(g)═CO(g)+H2(g):向甲、乙、丙三个恒容容器中加入一定量C和H2O,各容器中温度、反应物的起始量如下表,反应过程中CO的物质的量浓度随时间变化如图所示.下列说法正确的是( )
一定条件下存在反应C(s)+H2O(g)═CO(g)+H2(g):向甲、乙、丙三个恒容容器中加入一定量C和H2O,各容器中温度、反应物的起始量如下表,反应过程中CO的物质的量浓度随时间变化如图所示.下列说法正确的是( )| 容器 | 甲 | 乙 | 丙 |
| 容积 | 0.5L | 0.5L | V |
| 温度 | T1℃ | T2℃ | T1℃ |
| 起始量 | 2molC 1molH2O | 1molCO 1molH2 | 4molC 2molH2O |
| A. | 甲容器中,反应在前15min的平均速率v(H2)=0.1 mol•L-1•min-1 | |
| B. | 丙容器的体积V>0.5L | |
| C. | 当温度为T1℃时,反应的平衡常数K=4.5 | |
| D. | 乙容器中,若平衡时n(H2O)=0.4 mol,则T1<T2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
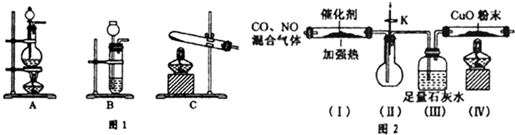
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 碳酸钙能与盐酸反应生成二氧化碳.类推:亚硫酸盐与所有的酸反应都能生成二氧化硫 | |
| B. | 浓硫酸与锌发生反应,先产生二氧化硫,后产生氢气.类推:浓硫酸与所有金属反应都能先产生二氧化硫,后产生氢气 | |
| C. | 浓盐酸、浓硝酸在空气中放置,溶液质量会减轻.类推:所有浓酸在空气中放置,溶液质量都会减轻 | |
| D. | 偏铝酸钠溶液能与碳酸氢钠溶液发生反应生成氢氧化铝.类推:向偏铝酸钠溶液中通入二氧化碳也能生成氢氧化铝 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1mol乙基(-C2H5)中含有的电子数为16NA | |
| B. | 8g CH4中含有10NA个电子 | |
| C. | 标准状况下22.4L氯仿(三氯甲烷)中共价键数目为4NA | |
| D. | 28g乙烯、丙烯、丁烯的混合气体,其碳原子数为2NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com