
【题目】工业上常用铁质容器盛装冷的浓硫酸。某兴趣小组的同学发现:将一定量的生铁与浓硫酸加热时,观察到固体能完全溶解,并产生大量气体。为探究反应后的产物,请你协助他们完成相关的实验。
[探究一]
(1)将已去除表面氧化物的铁钉(碳素钢)放入冷的浓硫酸中,10分钟后移入硫酸铜溶液中,片刻后取出观察,铁钉表面无明显变化,其原因是________________________。
(2)另称取铁钉6.0g放入15.0mL浓硫酸中,加热,充分反应后得到溶液X并收集到气体Y。
①甲同学认为X中除Fe3+外还可能含有Fe2+。若要判断溶液X中是否含有Fe2+,应选用________(填序号)。
a.KSCN溶液和氯水 b.K3[Fe(CN)6]溶液 c.浓氨水 d.酸性KMnO4溶液
②乙同学将336mL(标准状况)气体Y通入足量溴水中,发现溶液颜色变钱,试用化学方程式解释溴水颜色变浅的原因:__________________________________________________________,然后向反应后的溶液中加入足量BaCl2溶液,经适当操作得干燥固体2.33g。由此推知气体Y中SO2的体积分数为_________。
[探究二]
分析上述实验中SO2体积分数的结果,两同学认为气体Y中还可能含有H2和Q气体。为此设计如图所示探究实验装置(图中夹持仪器省略)。

(3)装置A中发生反应的离子方程式为_____________________,装置B中试剂的作用是____________。
(4)认为气体Y中还含有气体Q的理由是_____________________________(用化学方程式表示)。
为了进一步确认Q的存在,需在装置中添加装置M于_________(填序号),M中所加试剂为_________。
a.A~B之间 b.B~C之间 c.C~D之间 d.E~F之间
(5)利用上述实验装置进一步确认气体Y中是否含有H2,为达到预期的实验目的,加热前称量装置D的总质量为mg,当通入336mL(标准状况)气体Y完全反应后,继续通入氮气至装置D冷却到室温,称量装置D的质量为ng,则原混合气体中H2的体积分数为__________。(用含相关字母的代数式表示)
【答案】 铁钉表面被钝化 bd SO2+Br2+2H2O=2HBr+H2SO4 66.7% 2MnO4-+5SO2+2H2O=2Mn2++5SO42-+4H+ 检验SO2是否除尽 C+2H2SO4(浓)![]() CO2↑+2SO2↑+2H2O b Ca(OH)2或Ba(OH)2
CO2↑+2SO2↑+2H2O b Ca(OH)2或Ba(OH)2 ![]() ×100%
×100%
【解析】(1)铁钉放入冷硫酸中,浓硫酸有较强的氧化性能使铁钉钝化阻止反应进一步进行,
故答案为:铁钉表面被氧化;
(2)①溶液中已经有三价铁离子,选择a会造成干扰,b能检验二价铁离子的存在,选c生成两种沉淀,受氢氧化铁沉淀颜色的影响无法分辨,d中亚铁离子能使酸性高锰酸钾褪色,故选bd;
②SO2具有还原性,通入足量溴水中,发生SO2+Br2+2H2O=2HBr+H2SO4,生成的硫酸遇到氯化钡会产生白色沉淀,则n(混合气体)= ![]() =0.015mol;根据SO2 ~BaSO4,n(SO2)=n(BaSO4)=
=0.015mol;根据SO2 ~BaSO4,n(SO2)=n(BaSO4)= ![]() =0.01mol,所以二氧化硫的体积分数为:
=0.01mol,所以二氧化硫的体积分数为: ![]() ×100%=66.7%,故答案为:SO2+Br2+2H2O=2HBr+H2SO4;66.7%;
×100%=66.7%,故答案为:SO2+Br2+2H2O=2HBr+H2SO4;66.7%;
(3)A中高锰酸钾能够将二氧化硫氧化,除去二氧化硫,反应的离子方程式为2MnO4-+5SO2+2H2O=2Mn2++5SO42-+4H+,二氧化硫能使品红溶液褪色,所以B可以检验A中是否完全除去二氧化硫,故答案为:2MnO4-+5SO2+2H2O=2Mn2++5SO42-+4H+;检验二氧化硫是否除尽;
(4)在加热时,铁钉中不仅铁和浓硫酸反应,碳也和浓硫酸反应生成二氧化硫、二氧化碳和水,反应方程式为C+2H2SO4(浓硫酸)![]() CO2 ↑+2SO2↑+2H2O,所以气体二氧化硫还含有二氧化碳,Q为二氧化碳,二氧化碳和二氧化硫都能使澄清石灰水变浑浊,确认二氧化碳的存在,需要除去二氧化硫,但不能影响二氧化碳,AB装置除去了二氧化硫并检验二氧化硫完全除去,因此可以在B~C之间添加盛有澄清石灰水的检验二氧化碳,故答案为:C+2H2SO4(浓硫酸)
CO2 ↑+2SO2↑+2H2O,所以气体二氧化硫还含有二氧化碳,Q为二氧化碳,二氧化碳和二氧化硫都能使澄清石灰水变浑浊,确认二氧化碳的存在,需要除去二氧化硫,但不能影响二氧化碳,AB装置除去了二氧化硫并检验二氧化硫完全除去,因此可以在B~C之间添加盛有澄清石灰水的检验二氧化碳,故答案为:C+2H2SO4(浓硫酸)![]() CO2 ↑+2SO2↑+2H2O;b;Ca(OH)2或Ba(OH)2;
CO2 ↑+2SO2↑+2H2O;b;Ca(OH)2或Ba(OH)2;
(5)336mL(标准状况)气体的物质的量=![]() =0.015mol,装置D中发生氢气还原氧化铜的反应,生成的水被E和F吸收,完全反应后氧化铜转化为铜,失去的氧元素的质量为(m-n)g,物质的量为
=0.015mol,装置D中发生氢气还原氧化铜的反应,生成的水被E和F吸收,完全反应后氧化铜转化为铜,失去的氧元素的质量为(m-n)g,物质的量为![]() =
=![]() mol,因此混合气体中含有氢气
mol,因此混合气体中含有氢气![]() mol,则原混合气体中H2的体积分数为
mol,则原混合气体中H2的体积分数为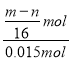 ×100%=
×100%=![]() ×100%,故答案为:
×100%,故答案为: ×100%。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】硒(Se)是第34号元素,是人体内不可或缺的微量元素,可以形成H2Se、SeO2、H2SeO3、H2SeO4、CuSe等多种化合物。请回答下列问题:
(1)硒在元素周期表中的位置________________________。
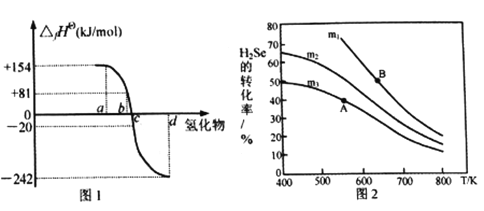
(2)在101kPa、一定温度(一般是298K)下,由稳定单质发生反应生成1mol化合物的反应热叫该化合物的标准生成热(△fHθ)。图1为氧族元素氢化物a、b、c、d呈气态时的生成热数据。
①图1中氢化物d的电子式为__________________________。
②在298K时,硒化氢分解反应的热化学反应方程式为__________________________。
③由图中数据计算,2H2Se(g)+O2(g) ![]() 2Se(s)+2H2O(g) △H=_____________KJ/mol
2Se(s)+2H2O(g) △H=_____________KJ/mol
(3)在恒容反应器中,将H2Se(g)和O2(g)按不同比例[n(H2Se)/n(O2)=m]投入反应器,测得反应2H2Se(g)+O2(g) ![]() 2Se(s)+2H2O(g)中H2Se的平衡转化率随温度变化如图2所示。则A、B两点平衡常数大小关系为KA________KB(填“<”、“>”或“=”),图中m1、m2、m3由大到小的顺序为 ____________,理由是____________________________________。
2Se(s)+2H2O(g)中H2Se的平衡转化率随温度变化如图2所示。则A、B两点平衡常数大小关系为KA________KB(填“<”、“>”或“=”),图中m1、m2、m3由大到小的顺序为 ____________,理由是____________________________________。
(4)常温下溶度积:Ksp(CuSe)=7.9x10-49,Ksp(CuS)=1.3×10-36。则反应CuS(s)+Se2-(aq) ![]() CuSe(s)+S2-(aq)的化学平衡常数K为____________(结果用科学记数法表示,并保留2位小数)。当溶液中c(S2-)=100c(Se2-)时,反应中v(正)_____v(逆)(填“<”、“>”或“=”) 。
CuSe(s)+S2-(aq)的化学平衡常数K为____________(结果用科学记数法表示,并保留2位小数)。当溶液中c(S2-)=100c(Se2-)时,反应中v(正)_____v(逆)(填“<”、“>”或“=”) 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各表述正确的是( )
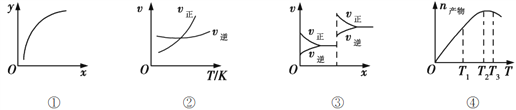
A. 图①表示在恒容容器中MgSO4(s) + CO(g)![]() MgO(s) + CO2(g) + SO2(g),横坐标代表硫酸镁的质量,纵坐标可代表CO的转化率
MgO(s) + CO2(g) + SO2(g),横坐标代表硫酸镁的质量,纵坐标可代表CO的转化率
B. 图②表示其他条件一定时,反应A(g)+3B(g)![]() 2C(g)的反应速率随温度变化的图像,正反应ΔH>0
2C(g)的反应速率随温度变化的图像,正反应ΔH>0
C. 图③对应的反应一定是非等体积反应加压后平衡移动的变化情况
D. 恒压密闭容器中加入一定量A、B,发生反应A(g)+3B(g)![]() 2C(g),图④表示反应过程中不断升高温度,产物C物质的量变化规律,则正反应方向吸热
2C(g),图④表示反应过程中不断升高温度,产物C物质的量变化规律,则正反应方向吸热
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组物质,按化合物、单质、混合物顺序排列的是( )
A.烧碱、液态氧、碘酒
B.生石灰、白磷、熟石灰
C.干冰、铁、氯化氢
D.空气、氮气、胆矾
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.高铁酸钾(K2FeO4)是一种新型、高效、多功能绿色环保水处理剂,比Cl2、O2、ClO2、KMnO4氧化性更强,无二次污染,工业上是先制得高铁酸钠,然后在低温下,向高铁酸钠溶液中加入KOH至饱和,使高铁酸钾析出。
(1)干法制备高铁酸钾的主要反应为:2FeSO4+ 6Na2O2=2Na2FeO4+2Na2O+2Na2SO4+O2↑,该反应中过氧化钠(Na2O2)中氧元素化合价为______,氧化产物是________________(填化学式)。
(2)湿法制备高铁酸钾(K2FeO4)的反应体系中有六种粒子:Fe(OH)3、ClO-、OH-、FeO42—、Cl-、H2O。
①碱性条件下,氧化剂和还原剂的物质的量的比为3:2发生反应,写出并配平湿法制高铁酸钾的离子反应方程式:_____________________________________________。
②每生成1 mol FeO42—转移________mol电子;若反应过程中转移了0.3 mol电子,则还原产物的物质的量为________mol。
Ⅱ.已知:2Fe3++2I-=2Fe2++I2 ,2Fe2++Br2=2Fe3++2Br-。
(1)含有1 mol FeI2和2 mol FeBr2的溶液中通入2 mol Cl2,此时被氧化的离子是________。
(2)若向含a mol FeI2和b mol FeBr2的溶液中通入c mol Cl2,当I-、Fe2+、Br-完全被氧化时,c为__________________(用含a、b的代数式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯及其化合物在生产、生活中有广泛的应用。请按照要求回答下列问题。
I.化合物A在一定条件下通过电解所得产品及其之间的反应如下图所示

(1)写出反应①离子方程式___________________。
(2)溶液G中还应有的溶质化学式为___________________。
II. 以氯酸钠(NaClO3)为原料制备亚氯酸钠(NaClO2)粗品的工艺流程如下图所示:

已知:i.纯ClO2易分解爆炸,空气中ClO2的体积分数在10%以下比较安全;
ii.NaClO2在碱性溶液中稳定存在,在酸性溶液中迅速分解;
iii.NaClO2饱和溶液在温度低于38℃时析出NaClO23H2O,等于或高于38℃时析出NaC1O2晶体,高 于60℃时分解成NaClO3和NaCl。
(1)试剂A应选择_______。(填字母)
a.浓硝酸 b. Na2SO3溶液 c. KMnO4溶液
(2)反应②的离子方程式为_______。
(3)已知压强越大,物质的沸点越高。反应②结束后采用“减压蒸发”操作的原因是_____。
(4)反应①进行过程中应持续鼓入空气,其目的是_______。
(5)系列操作依次是_______(写明条件和名称)、过滤、洗涤,最后在________条件下进行干燥,得到粗产品NaClO2。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按要求填空
(1)画出羟基和乙烯的电子式:羟基 __________,乙烯 __________。
(2)用系统命名法给下列有机物命名
![]() ___________________________;
___________________________;
②![]() ___________________________________;
___________________________________;
(3)相对分子质量为114,其一氯代物只有一种的链烃的结构简式 ___________该物质的名称为________________;
(4)某烃1分子含有50个电子,该烃只能由一种结构的炔烃加氢得到,则该烃的键线式为 _____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向Ba(OH)2和NaOH的混合溶液中逐渐通入CO2气体至过量,生成沉淀的物质的量(n)和通入CO2气体的(V) 的关系如图所示,试回答:

(1)0到a点之间的反应的离子方程式__________
(2)a到b点之间的反应的离子方程式__________
(3)b点之后的反应的离子方程式______________
(4)c 点CO2的体积__________mL(同温同压下)。
(5) 混合溶液中Ba(OH)2和NaOH 的物质的量之比为__________
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com