
下图两个装置中,溶液体积均为200mL,开始时,电解质溶液的浓度均为0.1mol/L, 工作一段时间后,测得导线上都通过了0.02mol e一,若不考虑溶液体积的变化,
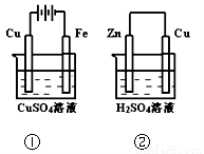
则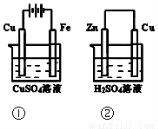 下列叙述正确的是
下列叙述正确的是
A.在①中Cu棒为阳极;在②中Cu棒为负极
B.电极上生成物质的质量:①<②
C.电极反应式:①中阳极:4OH一-4e一=2H2O+O2↑;②中负极:2H+ + 2e-= H2↑
D.溶液的pH:①不变;②增大
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源:2014-2015学年河北省高一12月月考化学试卷(解析版) 题型:选择题
某同学对一无色透明溶液进行分析得出该溶液中含有下列某组离子,你认为该组离子应该是
A.Al3+、NO3―、K+、SO42ˉ B.Ca2+、H+、CO32ˉ、AlO2―
C.OHˉ、SO42ˉ、NH4+、Al3+ D.Fe3+、Mg2+、NO3ˉ、Clˉ
查看答案和解析>>
科目:高中化学 来源:2014-2015学年河北省高二12月月考化学试卷(解析版) 题型:选择题
下列有关有机物的说法中正确的是:
A.凡是含碳元素的化合物都属于有机物;
B.易溶于汽油、酒精、苯等有机溶剂中的物质一定是有机物;
C.所有的有机物都很容易燃烧;
D.有机物所起的反应,一般比较复杂,速度缓慢,并且还常伴有副反应发生。
查看答案和解析>>
科目:高中化学 来源:2014-2015学年甘肃省高二上学期第二次月考化学试卷(解析版) 题型:填空题
(12分)工业制氢气的一个重要反应是:CO(g)+H2O(g)  CO2(g)+H2(g)现将不同量的CO(g)和H2O(g)分别通入到体积为2L的恒容密闭容器中进行反应,得到如下三组数据:
CO2(g)+H2(g)现将不同量的CO(g)和H2O(g)分别通入到体积为2L的恒容密闭容器中进行反应,得到如下三组数据:
实验组 | 温度℃ | 起始量/mol | 平衡量/mol | 达到平衡状态所需时间/min | ||
CO | H2O | H2 | CO2 | |||
I | 650 | 4 | 2 | 1.6 | 1.6 | 5 |
II | 900 | 2 | 1 | 0.5 | 0.5 | 3 |
①对于反应CO(g)+H2O(g)  CO2(g)+H2(g),下列说法正确的是
CO2(g)+H2(g),下列说法正确的是
A.当容器中CO的含量保持不变时,说明该反应达到平衡状态
B.若混合气体的密度不再改变,说明该反应已达化学平衡状态
C.实验I中,反应达到平衡后,再通入4molCO和2molH2O,平衡正向移动,H2的体积分数增大
D.若使用催化剂,会改变反应的途径,但反应的焓变不变
②实验I中,从反应开始到反应达到平衡时,CO的平均反应速率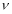 (CO)= ;
(CO)= ;
③实验II条件下反应的平衡常数K= (保留小数点后二位);H2O(g)的平衡转化率为 。
④若在900℃时,实验II反应达到平衡后,向此容器中再加入1.5molCO、0.5mol H2O、0.2mol CO2、0.5mol H2,则平衡向 方向移动(填“正反应”、“逆反应”或“不移动”)
⑤若仅改变温度,纵坐标y随T变化如图所示,则纵坐标y表示的是 。
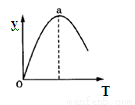
A.CO2的百分含量 B.混合气体的平均相对分子质量
C.CO的转化率 D.H2O的物质的量
查看答案和解析>>
科目:高中化学 来源:2014-2015学年甘肃省高二上学期第二次月考化学试卷(解析版) 题型:选择题
工业废水中常含有Cu2+、Cd2+、Pb2+等重金属离子,可通过加入过量的难溶电解质FeS、MnS,使这些金属离子形成硫化物沉淀除去。根据以上事实,可推知FeS、MnS具有的相关性质是
A.在水中的溶解能力大于 CuS、CdS、PbS
B.在水中的溶解能力小于CuS、CdS、PbS
C.在水中的溶解能力与CuS、CdS、PbS相同
D.二者均具有较强的吸附性
查看答案和解析>>
科目:高中化学 来源:2014-2015学年甘肃省高二上学期第二次月考化学试卷(解析版) 题型:选择题
在100mL 0.01mol/L KCl 溶液中,加入 1mL 0.01mol/L AgNO3溶液,下列说法正确的是(AgCl Ksp=1.8×10-10)
A.有AgCl沉淀析出 B.无AgCl沉淀
C.无法确定 D.有沉淀但不是AgCl
查看答案和解析>>
科目:高中化学 来源:2014-2015学年山西省校高一上学期期中化学试卷(解析版) 题型:选择题
已知0.1mol X2O72- 能将100mL,3mol/L SO32- 氧化成SO42-,则X元素被还原后的化合价是
A.0 B.+2 C.+3 D.+4
查看答案和解析>>
科目:高中化学 来源:2014-2015学年云南省蒙自市高二上学期期中化学试卷(解析版) 题型:填空题
(10分)在密闭容器中,使2 mol N2和6 mol H2混合发生下列反应:N2(g)+3H2(g)  2NH3(g) ΔH<0
2NH3(g) ΔH<0
(1)当反应达到平衡时,N2和H2的浓度比是________;N2和H2的转化率比是________。
(2)升高平衡体系的温度(保持体积不变),混合气体的平均相对分子质量__________,密度__________。(此题两个空填“变大”、“变小”或“不变”)
(3)当达到平衡时,充入氩气,并保持压强不变,平衡将________(填“正向”、“逆向”或“不”)移动。
(4)若容器恒容、绝热,加热使容器内温度迅速升至原来的2倍,平衡将________(填“向左移动”、“向右移动”或“不移动”)。达到新平衡后,容器内温度________(填“大于”、“小于”或“等于”)原来的2倍。
查看答案和解析>>
科目:高中化学 来源:2014-2015学年云南省高二上学期期中化学试卷(解析版) 题型:选择题
下列选项中说明乙醇作为燃料的优点的是
①燃烧时发生氧化反应 ②充分燃烧的产物不污染环境
③乙醇是一种再生能源 ④燃烧时放出大量的热
A.①②③ B.①②④ C.①③④ D.②③④
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com