
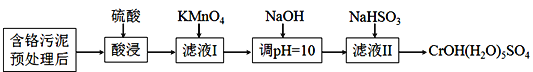
【题目】某含铬污泥主要含Cr2O3、Al2O3、Fe2O3等物质,该污泥可以用湿法回收利用,流程如下图所示:
已知:室温下部分氢氧化物的Ksp见下表
Al(OH)3 | Fe(OH)3 | Cr(OH)3 | Mn(OH)2 | |
Ksp | 3×10-34 | 4×10-38 | 6×10-31 | 4×10-14 |
(1)酸浸前,对含铬污泥进行预处理即加水湿磨成浆体,湿磨的作用是_____________。
(2)向滤液I加KMnO4氧化Cr3+的离子方程式是________________________________;将Cr3+氧化的目的是____________________________________________________。
(3)室温下,调pH=10时, ![]() =_____;调溶液pH不能大于10,理由是_________。
=_____;调溶液pH不能大于10,理由是_________。
(4)NaHSO3在反应中的作用是___________;理论上n(NaHSO3):n[CrOH(H2O)5SO4]之比是_______________。
(5)NaHSO3固体在空气中易变质,写出检验NaHSO3是否变质的方法______________。
【答案】 增大接触面积,加快反应速率,增加酸浸时金属元素浸出率 10 Cr3+ + 6MnO![]() + 11H2O=6Mn2+ + 5Cr2O
+ 11H2O=6Mn2+ + 5Cr2O![]() + 22H+ 防止调pH=10时,Cr3+生成Cr(OH)3沉淀使铬回收率下降 7.5×103 防止碱性过强Al(OH)3沉淀溶解生成AlO
+ 22H+ 防止调pH=10时,Cr3+生成Cr(OH)3沉淀使铬回收率下降 7.5×103 防止碱性过强Al(OH)3沉淀溶解生成AlO![]() ,无法分离 还原剂 3:2 取少量NaHSO3固体加适量水溶解,先加稀盐酸再加BaCl2溶液,若有白色沉淀生成,则NaHSO3已变质;若无白色沉淀则未变质
,无法分离 还原剂 3:2 取少量NaHSO3固体加适量水溶解,先加稀盐酸再加BaCl2溶液,若有白色沉淀生成,则NaHSO3已变质;若无白色沉淀则未变质
【解析】(1)酸浸前,对含铬污泥进行预处理即加水湿磨成浆体,湿磨可以增大接触面积,加快反应速率,增加酸浸时金属元素浸出率,故答案为:增大接触面积,加快反应速率,增加酸浸时金属元素浸出率;
(2)KMnO4氧化Cr3+的离子方程式为10 Cr3+ + 6 MnO4-+ 11H2O=6Mn2+ + 5Cr2O72- + 22H+;根据氢氧化物的Ksp,将Cr3+氧化可以防止调pH=10时,Cr3+生成Cr(OH)3沉淀使铬回收率下降,故答案为:10 Cr3+ + 6 MnO4-+ 11H2O=6Mn2+ + 5Cr2O72- + 22H+;防止调pH=10时,Cr3+生成Cr(OH)3沉淀使铬回收率下降;
(3)室温下,调pH=10时, ![]() =
=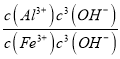 =
=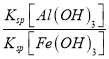 =
=![]() =7.5×103;为了防止碱性过强Al(OH)3沉淀溶解生成AlO2-,无法分离,溶液pH不能大于10,故答案为:7.5×103;防止碱性过强Al(OH)3沉淀溶解生成AlO2-,无法分离;
=7.5×103;为了防止碱性过强Al(OH)3沉淀溶解生成AlO2-,无法分离,溶液pH不能大于10,故答案为:7.5×103;防止碱性过强Al(OH)3沉淀溶解生成AlO2-,无法分离;
(4)加入NaHSO3可以将溶液的Cr2O72-还原为Cr3+;根据得失电子守恒,理论上n(NaHSO3)×(6-4)=n[CrOH(H2O)5SO4]×(6-3),解得n(NaHSO3):n[CrOH(H2O)5SO4]=3:2,故答案为:还原剂;3:2;
(5)NaHSO3固体在空气中易被空气氧化为硫酸氢钠而变质,检验NaHSO3是否变质只需要检验硫酸根离子即可,方法为取少量NaHSO3固体加适量水溶解,先加稀盐酸再加BaCl2溶液,若有白色沉淀生成,则NaHSO3已变质;若无白色沉淀则未变质,故答案为:取少量NaHSO3固体加适量水溶解,先加稀盐酸再加BaCl2溶液,若有白色沉淀生成,则NaHSO3已变质;若无白色沉淀则未变质。


 考前必练系列答案
考前必练系列答案科目:高中化学 来源: 题型:
【题目】药物贝诺酯可由乙酰水杨酸和对乙酰氨基酚在一定条件下反应制得:

下列有关叙述正确的是
A.可用FeCl3溶液区别乙酰水杨酸和对乙酰氨基酚
B.贝诺酯分子中有三种含氧官能团
C.乙酰水杨酸和对乙酰氨基酚均能与Na2CO3 溶液反应
D.贝诺酯与足量NaOH 溶液共热,最终生成乙酰水杨酸钠和对乙酰氨基酚
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】能较好说明乙醇分子结构简式为C2H5OH,而不是CH3OCH3的事实是( )
A. 1mol乙醇完全燃烧只生成2molCO2和3molH2O
B. 乙醇无同分异构体
C. 0.1mol乙醇与足量钠反应只产生0.05mol氢气
D. 乙醇与水以任意比例互溶
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,在20ml 0.1mol·L-1NaOH溶液中逐滴加入0.2mol·L-1醋酸溶液,滴定曲线如图所 示,有关粒子浓度的关系中,不正确的是( )

A. 在A点:c(Na+)﹥c(OH-)﹥c(CH3COO-)﹥c(H+)
B. 在B点:c(Na+) ﹦c(CH3COO-) ﹥c(OH-)﹦c(H+)
C. 在C点:c(CH3COO-)﹥c(Na+)﹥c(H+) ﹥c(OH-)
D. 在C点:c(CH3COO-)+c(CH3COOH)﹦2 c(Na+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用催化氧化反应将SO2转化为SO3是工业上生产硫酸的关键步骤。
(1)T1℃时,在2L密闭容器中充入0.6molSO3,图1表示SO3物质的量随时间的变化曲线。

①平衡时,SO3的转化率为______(保留一位小数);在T1℃下反应2SO2(g)+O2(g) ![]() 2SO3(g) 的平衡常数为____________;若其他条件不变,在8min时压缩容器的体积至1L,则n(SO3)的变化曲线为_______(填字母)。
2SO3(g) 的平衡常数为____________;若其他条件不变,在8min时压缩容器的体积至1L,则n(SO3)的变化曲线为_______(填字母)。
②下表为不同温度(T)下反应2SO2(g)+O2(g) ![]() 2SO3(g) △H<0的化学平衡常数(K):
2SO3(g) △H<0的化学平衡常数(K):
T/℃ | T2 | T3 |
K | 20.5 | 4.68 |
由此推知,其他条件相同,在T1、T2、T3三种不同温度下,反应从开始至达到平衡时所需要的时间最长的是 _____________。(填“T1”、“T2”或“T3”)
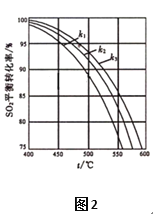
(2)在体系恒压的条件下进行反应:2SO2(g)+O2(g) ![]() 2SO3(g),原料气中SO2和O2的物质的量之比(k)不同时,SO2的平衡转化率与温度(t)的关系如图2所示:图中k1、k2、k3的大小顺序为____________。
2SO3(g),原料气中SO2和O2的物质的量之比(k)不同时,SO2的平衡转化率与温度(t)的关系如图2所示:图中k1、k2、k3的大小顺序为____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应既属于氧化还原反应,又是吸热反应的是( )
A.铝片与稀盐酸的反应
B.Ba(OH)2·8H2O与NH4Cl的反应
C.灼热的炭与CO2的反应
D.甲烷在氧气中的燃烧反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验装置中,设计合理的是
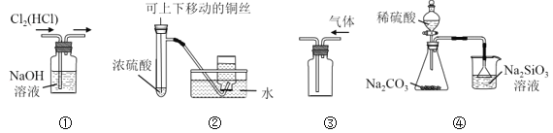
A. 图①用于除去Cl2中混有的HCl气体
B. 图②用于制取并收集少量SO2气体
C. 图③用于排空气法收集CO2气体
D. 图④比较硫、碳、硅三种元素的非金属性强弱
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)键线式![]() 表示的分子式____________________;名称是________________________。
表示的分子式____________________;名称是________________________。
(2) 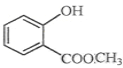 中含有的官能团的名称为_____________________________________。
中含有的官能团的名称为_____________________________________。
(3)丙基的两种结构简式为____________________、______________________。
(4)写出下列有机物的结构简式
2,2,3,3-四甲基戊烷_____________________________
3,4-二甲基-4-乙基庚烷______________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有X、Y、Z、W四种短周期主族元素,原子序数依次增大,元素性质与原子(或分子)结构如下表所示:
元素编号 | 元素性质与原子(或分子)结构 |
X | 原子核内没有中子 |
Y | 常温下单质为双原子分子,分子中含有3对共用电子对 |
Z | 最内层电子数是最外层的2倍 |
W | 本周期元素中原子半径最小 |
请回答:
(1)写出元素Z在周期表中的位置______,画出元素W的原子结构示意图______。
(2)Y与W相比,气态氢化物稳定性较弱的是________(填化学式,下同),两元素最高价氧化物对应水化物酸性更强的是__________。
(3)X、Y、Z三种元素可以形成化合物ZYX2,可与化合物XW发生反应,生成两种盐,写出该反应的化学方程式________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com