
下列有关电化学知识的描述正确的是
A.CaO+H2O== Ca(OH)2可以放出大量的热,故可把该反应设计成原电池,把其中的化学能转化为电能
B.某原电池反应为Cu+2AgNO3===Cu(NO3)2+2Ag装置中的盐桥中可以是装有含琼胶的KCl饱和溶液
C.因为铁的活泼性强于铜,所以将铁、铜用导线连接后放入浓硝酸中,若能组成原电池,必是铁作负极,铜作正极
D.理论上说,任何能自发进行的氧化还原反应都可设计成原电池
 学练快车道口算心算速算天天练系列答案
学练快车道口算心算速算天天练系列答案科目:高中化学 来源: 题型:
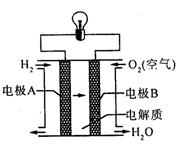
氢氧燃料电池是一种新能源,如图为氢氧燃料
电池示意图。下列说法不正确的是
A. 该装置能将化学能转化为电能
B. A极是正极,B极是负极
C. 电子由A极通过导线流向B极
D. 产物为无污染的水,属于环境友好电池
查看答案和解析>>
科目:高中化学 来源: 题型:
只用哪一种试剂就可将AgNO3、 KSCN、 稀H2SO4 、NaOH 4种无色溶液区分开( )
A.BaCl2溶液 B.FeCl2溶液 C. FeCl3溶液 D.NaOH溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
化合物HIn在水溶液中因存在以下电离平衡,故可用作酸碱指示剂
HIn(红色溶液)  H+(溶液)+ In-(黄色溶液)
H+(溶液)+ In-(黄色溶液)
浓度为0.02 mol·L-1的下列各溶液: ①盐酸 ②石灰水 ③NaCl溶液 ④NaHSO4溶液 ⑤NaHCO3溶液 ⑥氨水,⑦AlCl3溶液其中能使指示剂显红色的是
A.②⑤⑥ B.①④ ⑤ C.①④⑦ D.① ④⑤⑦
查看答案和解析>>
科目:高中化学 来源: 题型:
碱性电池具有容量大、放电电流大的特点,因此得到 广泛的应用。锌锰碱性电池以氢氧化钾溶液为电解液,电池总反应为Zn(s)+2MnO2(s)+H2O== Zn(OH)2(s)+ Mn2O3(s),下列说法错误的是
A. 电池工作时,锌失去电子
B. 电池负极的电极反应式为:Zn-2e-+2OH-== Zn(OH)2
C. 电池工作时,电子由正极通外电路流向负极
D. 外电路中每通过0.2mol电子,锌的质量理论上减小6.5g
查看答案和解析>>
科目:高中化学 来源: 题型:
下列叙述正确的是 ( )
A.生成物总能量一定低于反应物总能量
B.放热反应的反应速率总是大于吸热反应的反应速率
C.应用盖斯定律,可以计算某些难于直接测量的反应的反应热
D.△H大于零的反应是放热反应
查看答案和解析>>
科目:高中化学 来源: 题型:
在两个恒容的密闭容器中进行下列两个可逆反应:
甲:C(s)+H2O(g)  CO(g)+H2(g); 乙:CO(g)+H2O(g)
CO(g)+H2(g); 乙:CO(g)+H2O(g)  CO2(g)+H2(g)
CO2(g)+H2(g)
现有下列状态:①混合气体平均相对分子质量不再改变
②恒温时,气体压强不再改变 ③各气体组成浓度相等
④反应体系中温度保持不变 ⑤断裂氢氧键速率是断裂氢氢键速率的2倍
⑥混合气体密度不变 ⑦单位时间内,消耗水质量与生成氢气质量比为9∶1
其中能表明甲、乙容器中反应都达到平衡状态的是( )
A.①②⑤ B.③④⑥ C.⑥⑦ D.④⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
检验SO2中是否混有CO2气体,可采用的方法是( )
A.通过澄清的石灰水 B.通过NaOH溶液,再通过澄清石灰水
C.先通过酸性KMnO4溶液,再通过澄清石灰水
D.先通过NaHCO3溶液,再通过澄清石灰水
查看答案和解析>>
科目:高中化学 来源: 题型:
下列化合物:①HCl ②NaOH ③CH3COOH ④NH3·H2O ⑤CH3COONa ⑥NH4Cl ⑦C2H5OH ⑧SO2
(1)属于弱电解质的是 ,溶液呈碱性的有 (填序号)。
(2)常温下0.01 mol/L NaOH溶液的pH= ;pH=11的CH3COONa溶液中由水电离产生的c(OH-) = 。
mol/L NaOH溶液的pH= ;pH=11的CH3COONa溶液中由水电离产生的c(OH-) = 。
(3)用离子方程式表示CH3COONa溶液呈碱性的原因 ,其溶液中离子浓度按由大到小的顺序为 。
 (4)常温下,向100 mL 0.01 mol·L-1HA溶液逐滴加入0.02 mol·L-1MOH 溶液,图中所示曲线表示混合溶液的pH变化情况(体积变化忽略不计)。回答下列问题:
(4)常温下,向100 mL 0.01 mol·L-1HA溶液逐滴加入0.02 mol·L-1MOH 溶液,图中所示曲线表示混合溶液的pH变化情况(体积变化忽略不计)。回答下列问题:
①由图中信息可知HA为_______酸
(填“强”或“弱”)。
②在滴加过程中,水的电离程度的变化是先 后 (填“增大”、“减小”或“不变”)
③K点对应的溶液中, c(M+)+c(MOH)= mol·L-1。
(5)在25 ℃下,向浓度均为0.01 mol·L-1的FeCl3和CuCl2混合溶液中逐滴加入氨水,先生成__________沉淀(填化学式),当测得溶液pH=11时,则此温度下残留在溶液中的c(Cu2+):c(Fe3+)
= 。
(已知25℃时Ksp[Fe(OH)3]=4.0×10-38, Ksp[Cu(OH)2]=2.2×10-20)
(6)25℃时,将bmol NH4NO3溶于水,向该溶液滴加aL氨水后溶液呈中性,则所滴加氨水的浓度为_______mol·L-1。(NH3·H2O的电离平衡常数取Kb = 2×10-5 mol·L-1)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com