
| 金属离子 | 开始沉淀的pH | 沉淀完全的pH |
| Fe3+ | 1.1 | 3.2 |
| Fe2+ | 5.8 | 8.8 |
| Co2+ | 6.9 | 9.4 |
分析 (1)由题目信息,二价Fe被氧化为三价Fe,可知该反应的反应物为FeSO4、NaOH和O2,产物为FeOOH,同时生成Na2SO4,书写配平方程式;
(2)加热固体用坩埚,与其配套的有泥三角、三脚架、坩埚钳、酒精灯等;
(3)氢气易燃,在有氧气存在下加热会发生爆炸,故先用氮气排尽空气;
(4)取最后一次洗涤滤出液少许于试管中,滴加氯化钡溶液,检验是否含有硫酸根离子;根据过滤的注意事项分析滤液浑浊的可能原因;
(5)第①分离出LiCoO2粗品,第②应用硫酸溶解粗品,用双氧化水把生成的杂质亚铁离子氧化为铁离子,可以用双氧化水;第③沉淀除去铁离子,得到纯净的溶液,第④应得到Co(OH)2沉淀,应加入氢氧化钠溶液调节pH≥9.4,使钴沉淀完全,第⑤将Co(OH)2沉淀溶于稀硫酸中,蒸发浓缩、冷却结晶、洗涤、干燥得到纯净物,对杂质溶解非常大或者非常小的可用重结晶进行提纯.
解答 解:(1)由题目信息,二价Fe被氧化为三价Fe,可知该反应的反应物为FeSO4、NaOH和O2,产物为FeOOH,同时生成Na2SO4,配平书写方程式为:4FeSO4+8NaOH+O2$\frac{\underline{\;40℃\;}}{\;}$4FeOOH+4Na2SO4+2H2O,
故答案为:4FeSO4+8NaOH+O2$\frac{\underline{\;40℃\;}}{\;}$4FeOOH+4Na2SO4+2H2O;
(2)加热固体用坩埚,与其配套的有泥三角、三脚架、坩埚钳、酒精灯等,
故选:cde;
(3)氢气易燃,在有氧气存在下加热会发生爆炸,故先用氮气排尽空气,防止氢气与氧气混合反应爆炸,
故答案为:排尽装置中的空气,防止氢气与氧气混合反应爆炸;
(4)产品洗涤不干净,会附着硫酸盐,检验洗涤滤出液中是否含有硫酸根离子判断是否洗涤干净,检验粗产品洗涤干净的实验操作和现象是:取最后一次洗涤滤出液少许于试管中,滴加氯化钡溶液,如果不产生白色沉淀,则表明洗涤干净.过滤后滤液仍然浑浊,可能的原因是:滤纸破损、液面高于滤纸边缘,液体从漏斗和滤纸间的缝隙流下,还可能是承接滤液的烧杯不干净,
故答案为:取最后一次洗涤滤出液少许于试管中,滴加氯化钡溶液,如果不产生白色沉淀,则表明洗涤干净; 玻璃棒抵住滤纸时滤纸破裂、原液液面高于滤纸边缘(合理即可);
(5)②:第①分离出LiCoO2粗品,第③得CoSO4溶液,并沉淀除去铁离子,故第②应用硫酸溶解粗品,且需把生成的杂质亚铁离子氧化为铁离子,可以用双氧化水;
故答案为:用稀硫酸溶解LiCoO2,并加入过量H2O2;
④:第③得到纯净的溶液,第④应得到Co(OH)2沉淀,应加入氢氧化钠溶液调节pH≥9.4,使钴沉淀完全,并洗涤、干燥得到纯净物;
故答案为:向③所得滤液中加入NaOH溶液,调节pH至9.4,过滤,洗涤得到Co(OH)2沉淀.
⑤:制CoSO4•7H2O晶体包含的主要实验操作步骤是:蒸发浓缩、冷却结晶、过滤、洗涤、干燥,若欲再提纯,因杂质含量小,可以通过重结晶再提纯,
故答案为:冷却结晶; 重结晶.
点评 本题考查CoxFe3-xO4的制备,涉及沉淀的生成、化学实验等,需要学生具有扎实的基础与运用知识分析解决问题的能力,题目难度中等.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
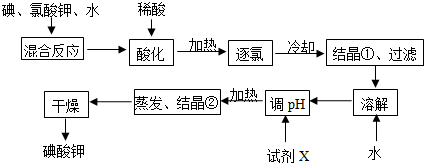
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| Mn(OH)2 | Fe(OH)2 | Fe(OH)3 | Cu(OH)2 | |
| 开始沉定时 | 8.3 | 7.6 | 2.7 | 6.7 |
| 完全沉淀时 | 9.8 | 9.6 | 3.7 | 9 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
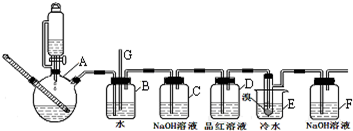
| 乙醇 | 1,2-二溴乙烷 | 乙醚 | |
| 状态 | 无色液体 | 无色液体 | 无色液体 |
| 密度/g/cm3 | 0.79 | 2.2 | 0.71 |
| 沸点/℃ | 78.5 | 132 | 34.6 |
| 熔点/℃ | -130 | 9 | -1l6 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
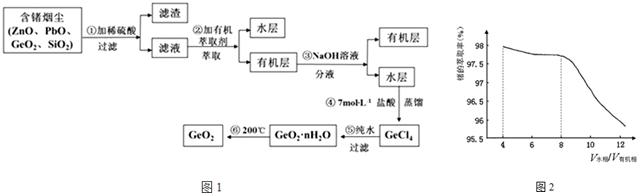
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
 在试管a中加入3mL 乙醇,然后边振荡试管边慢慢加入2mL浓硫酸和2mL 乙酸,按图所示,连接好装置进行实验,以制取乙酸乙酯.回答下列问题:
在试管a中加入3mL 乙醇,然后边振荡试管边慢慢加入2mL浓硫酸和2mL 乙酸,按图所示,连接好装置进行实验,以制取乙酸乙酯.回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1mol N2(g)和 3mol H2(g)具有的能量之和低于 2 mol NH3(g)具有的能量 | |
| B. | 将 1mol N2(g)和 3mol H2(g)置于一密闭容器中充分反应后放出 Q kJ 的热量 | |
| C. | 升高温度,平衡向逆反应方向移动,上述热化学方程式中的 Q 值减小 | |
| D. | 将一定量 N2、H2置于某密闭容器中充分反应放热 Q kJ,则此过程中有 3mol H2被氧化 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 将4 g NaOH溶解在1L蒸馏水中 | |
| B. | 用托盘天平称量5.85g NaCl固体溶于蒸馏水,配成1000mL溶液 | |
| C. | 常温常压下,将11.2L HCl气体溶于蒸馏水,配成500mL溶液 | |
| D. | 取50 mL 0.5mol/L 的KNO3溶液用蒸馏水稀释,配成250mL 溶液 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com