
 互动课堂系列答案
互动课堂系列答案 激活思维智能训练课时导学练系列答案
激活思维智能训练课时导学练系列答案科目:高中化学 来源: 题型:
两烧杯中分别加入足量的铝分别与等物质的量浓度的稀硫酸和氢氧化钠溶液反应,放出的气体体积在标准状况下相等,则所取稀硫酸和氢氧化钠溶液的体积比为
A.1︰2 B.3︰2 C.3︰1 D.6︰1
查看答案和解析>>
科目:高中化学 来源: 题型:
某兴趣小组进行“活泼金属与酸反应”的实验,
将5.4g的铝片投入500 mL 0.5 mol·L-1的硫酸溶液中,下
图为反应产生氢气速率与反应时间的关系图。
(1)关于图像的描述不正确的是 (填序号,下同)。
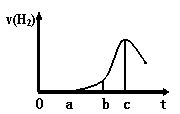 ① a → b段产生H2加快可能是表面的氧化膜逐渐溶解,
① a → b段产生H2加快可能是表面的氧化膜逐渐溶解,
加快了反应速率
② b → c段产生H2较快可能是该反应放热,导致温度升高,加快了反应
③ c以后,产生H2速率逐渐下降可能是铝片趋于消耗完全
(2)其他条件不变,现换用500 mL 1 mol·L-1盐酸,产生氢气速率普遍较使用500 mL
0.5 mol·L-1硫酸的快,可能的原因是________。
①盐酸中c(H+)的浓度更大 ②Cl-有催化作用
③SO42-有催化作用 ④SO42-有阻化作用(使反应变慢)
⑤Al3+有催化作用
(3)要加快铝与硫酸溶液制H2的反应速率,小组成员提出一系列方案,比如:
①加入某种催化剂 ②加入蒸馏水
③将铝片换成铝粉 ④增加硫酸的浓度至18 mol/L
⑤ ⑥ 。
以上方案不合理的有 ;请你再补充两种合理方案,填入空白⑤⑥处。
查看答案和解析>>
科目:高中化学 来源: 题型:
在一定温度不同压强(P1<P2)下,可逆反应2X(g) 2Y(g) + Z(g)中,生成物Z在反应混合物中的体积分数(ψ)与反应时间(t)的关系有以下图示,正确的是( )
2Y(g) + Z(g)中,生成物Z在反应混合物中的体积分数(ψ)与反应时间(t)的关系有以下图示,正确的是( )
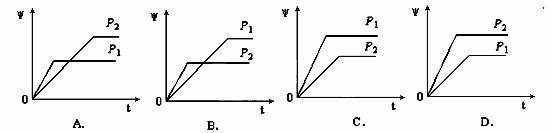
查看答案和解析>>
科目:高中化学 来源: 题型:
下图表示在密闭容器中反应:2SO2+O2 2SO3, △H < 0达到平衡时,由于条件改变而引起反应速度和化学平衡的变化情况,a b过程中改变的条件可能是 ;b c过程中改变的条件可能是 ; 若增大压强时,反应速度变化情况画在c~d处.。
2SO3, △H < 0达到平衡时,由于条件改变而引起反应速度和化学平衡的变化情况,a b过程中改变的条件可能是 ;b c过程中改变的条件可能是 ; 若增大压强时,反应速度变化情况画在c~d处.。
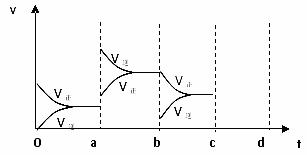
查看答案和解析>>
科目:高中化学 来源: 题型:
下列结论是从某同学的作业本上摘录的,其中你认为肯定正确的是( )
①微粒半径:S2->Cl>S>F
②氢化物的稳定性:HF>HCl>H2S>H2Se
③还原性:S2->Cl->Br->I- ④氧化性:Cl2>S>Se>Te
⑤酸性:H2SO4>HClO4>H2SeO4 ⑥得电子能力:F>Cl>S>Se
A.①⑤ B.①③④ C.②④⑥ D.⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
已知某反应aA(g)+ bB(g)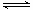 2C(g)的各物质浓度数据如下:
2C(g)的各物质浓度数据如下:
| A | B | C | |
| 起始浓度(mol/L) | 3.0 | 1.0 | 0 |
| 2s末浓度(mol/L) | 1.8 | 0.6 | 0.8 |
据此可推算出上述方程式中各物质的化学计量数之比是( )
A. 9:3:4 B. 3:1:2
C. 2:1:3 D. 3:2:1
查看答案和解析>>
科目:高中化学 来源: 题型:
以下物质:(1) 甲烷;(2) 苯;(3) 聚乙烯;(4) 聚乙炔;(5) 2-丁炔;(6) 环己烷;(7) 邻二甲苯;(8) 苯乙烯.既能使KMnO4酸性溶液褪色,又能使溴水因发生化学反应而褪色的是( )
A.(3)(4)(5)(8) B.(4)(5)(7)(8)
C.(4)(5)(8) D.(3)(4)(5)(7)(8)
查看答案和解析>>
科目:高中化学 来源: 题型:
下列实验能获得成功的是
A.乙烯通入Br2的CCl4溶液中制备CH2Br—CH2Br
B.苯和浓溴水用铁作催化剂制溴苯
C.CH4与Cl2在光照条件下制备纯净的CH3Cl
D.氯乙烷与NaOH溶液共热,在水解后的溶液中直接加入AgNO3溶液检验Cl-
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com