
分析 摩尔质量在数值上等于其相对分子质量,根据n=$\frac{m}{M}$、V=nVm计算二氧化碳质量、体积.
解答 解:摩尔质量在数值上等于其相对分子质量,所以二氧化碳摩尔质量是44g/mol,1g二氧化碳物质的量n=$\frac{m}{M}$=$\frac{mg}{44g/mol}$=$\frac{m}{44}$mol、V=nVm=$\frac{m}{44}mol×22.4L/mol$=$\frac{22.4m}{44}$L,
故答案为:44g/mol;$\frac{m}{44}$mol;$\frac{22.4m}{44}$L.
点评 本题考查物质的量有关计算,为高频考点,明确各个物理量关系是解本题关键,注意气体摩尔体积适用范围及适用条件,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 以B表示的平均反应速率为v(B)=0.13mol•L-1•min-1 | |
| B. | 4min时,A的物质的量为0.75mol | |
| C. | 该反应方程式中,x=2 | |
| D. | 4min时,A的转化率为60% |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 醋酸浓度/mol•L-1 | 0.001 0 | 0.010 0 | 0.020 0 | 0.100 0 | 0.200 0 |
| pH | 3.88 | 3.38 | 3.23 | 2.88 | 2.73 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 同时增大 | B. | 同时减小 | C. | v1增大,v2减小 | D. | v1减小,v2增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
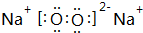
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NH3能氧化氮氧化物,可用于汽车尾气净化 | |
| B. | Mg、Fe等金属在一定条件下与水反应都生成H2和对应的氢氧化物 | |
| C. | Fe在氧气中的燃烧产物可用于制红色涂料 | |
| D. | Mg(OH)2分解吸热且生成高熔点固体,可作阻燃剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 离子组 | 加入试剂 | 加入试剂后发生反应的离子方程式 |
| A | Fe2+、NO${\;}_{3}^{-}$、NH${\;}_{4}^{+}$ | NaHSO4溶液 | 3Fe${\;}^{2{+}_{\;}^{\;}}$+NO${\;}_{3}^{-}$+4H+═3Fe3++NO↑+2H2O |
| B | Ca2+、HCO${\;}_{3}^{-}$、Cl- | 少量NaOH溶液 | Ca2++2HCO${\;}_{3}^{-}$+2OH-═2H2O+CaCO3↓+CO${\;}_{3}^{2-}$ |
| C | K+、AlO${\;}_{2}^{-}$、HCO${\;}_{3}^{-}$ | 通入少量CO2 | 2AlO${\;}_{2}^{-}$+3H2O+CO2═2Al(OH)3↓+CO${\;}_{3}^{2-}$ |
| D | NH${\;}_{4}^{+}$、Al3+、SO${\;}_{4}^{2-}$ | 少量Ba(OH)2溶液 | 2NH${\;}_{4}^{+}$+SO${\;}_{4}^{2-}$+Ba2++2OH-═BaSO4↓+2NH3.H2O |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com