
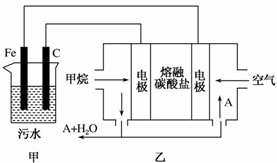
 工业上采用的一种污水处理方法如下:保持污水的pH在5.0~6.0之间,通过电解生成Fe(OH)3.Fe(OH)3具有吸附性,可吸附污物而沉积下来,有净化水的作用.某科研小组用该原理处理污水,设计的装置如图所示.下列说法正确的是( )
工业上采用的一种污水处理方法如下:保持污水的pH在5.0~6.0之间,通过电解生成Fe(OH)3.Fe(OH)3具有吸附性,可吸附污物而沉积下来,有净化水的作用.某科研小组用该原理处理污水,设计的装置如图所示.下列说法正确的是( )| A. | 为了增加污水的导电能力,应向污水中加入适量的H2SO4溶液 | |
| B. | 甲装置中Fe电极的反应为Fe-3e-═Fe3+ | |
| C. | 为了使燃料电池乙长时间稳定运行,电池的电解质组成应保持稳定,电池工作时,循环的物质A为CO2 | |
| D. | 当乙装置中有1.6 gCH4参加反应时,C电极理论上生成气体的体积在标况下为4.48 L |
分析 甲装置为电解池,乙装置为原电池装置,原电池工作时,通入甲烷的一级为负极,发生氧化反应,负极电极反应是CH4+4CO32--8e-=5CO2+2H2O,通入氧气的一级为正极,发生还原反应,正极反应为O2+2CO2+4e-=2CO32-,电解池中Fe为阳极,发生Fe-2e-=Fe2+,阴极的电极反应为:2H++2e-=H2↑,二价铁离子具有还原性,能被氧气氧化到正三价,4Fe2++10H2O+O2=4Fe(OH)3↓+8H+,以此解答该题.
解答 解:A.保持污水的pH在5.0~6.0之间,通过电解生成Fe(OH)3沉淀时,加入的使导电能力增强的电解质必须是可溶于水的、显中性的盐,加入硫酸不能生成Fe(OH)3沉淀,故A错误;
B.电解池中Fe为阳极,发生Fe-2e-=Fe2+,故B错误;
C.电池是以熔融碳酸盐为电解质,负极电极反应是CH4+4CO32--8e-=5CO2+2H2O,正极反应为O2+2CO2+4e-=2CO32-,可以循环利用的物质只有二氧化碳,故C正确;
D.阴极的电极反应为:2H++2e-=H2↑,阴极产生了44.8L(标准状况)即2mol的氢气产生,所以转移电子的物质的量为4mol,根据电池的负极电极反应是CH4+4CO32--8e-=5CO2+2H2O,当乙装置中有1.6 gCH4参加反应,即0.1mol甲烷参加反应时,有0.8mol电子转移,则C电极理论上生成气体在标准状况下为8.96L,故D错误.
故选C.
点评 本题考查了燃料电池的工作原理和原电池和电解池串联的综合知识,难度较大.注意把握电解池和原电池的工作原理,把握电极方程式的书写,为解答该题的关键.


科目:高中化学 来源: 题型:选择题
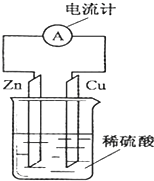
| A. | 电子由铜片通过导线流向锌片 | |
| B. | 铜为正极,铜不易失电子而受到保护 | |
| C. | 锌片为负极,且锌片逐渐溶解 | |
| D. | 该装置能将化学能转变为电能 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
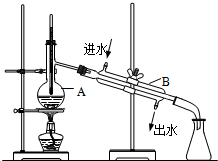 如图为实验室制取蒸馏水的装置示意图,根据图示回答下列问题.
如图为实验室制取蒸馏水的装置示意图,根据图示回答下列问题.查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | NH4NO3固体 | B. | NaOH固体 | C. | CaCl2固体 | D. | NaHSO4固体 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 元素A、B、C、D、E、F是位于元素周期表前四周期元素,且原子序数依次增大.其中 D、F为常见金属元素;A元素原子核内只有一个质子,元素A与B形成的气态化合物甲在标准状况下的密度为0.759g•L-1,C元素原子的最外层电子数是其电子层数的3倍,E与C同主族,由D或F元素组成的单质或某些离子(或化合物)在溶液中均有下列转化关系(如图,其它参与反应的物质未列出):
元素A、B、C、D、E、F是位于元素周期表前四周期元素,且原子序数依次增大.其中 D、F为常见金属元素;A元素原子核内只有一个质子,元素A与B形成的气态化合物甲在标准状况下的密度为0.759g•L-1,C元素原子的最外层电子数是其电子层数的3倍,E与C同主族,由D或F元素组成的单质或某些离子(或化合物)在溶液中均有下列转化关系(如图,其它参与反应的物质未列出):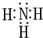 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Fe-2e-=2Fe2+ | B. | Fe-3e=Fe3+ | ||
| C. | 2H2O+O2+4e-=4OH- | D. | 4OH--4e-=2H2O+O2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
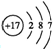 ,B中所含的化学键有离子键、共价键.又知X溶液显碱性,其原因是(用离子方程式表示)ClO-+H2O?HClO+OH-.
,B中所含的化学键有离子键、共价键.又知X溶液显碱性,其原因是(用离子方程式表示)ClO-+H2O?HClO+OH-.查看答案和解析>>
科目:高中化学 来源: 题型:实验题
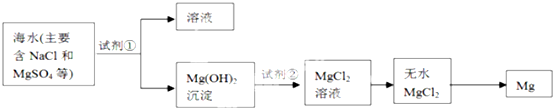
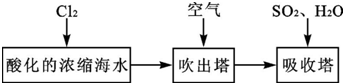
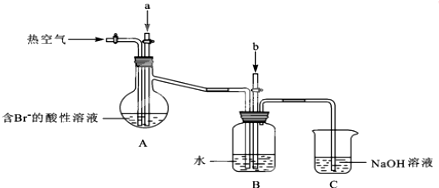
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com