

分析 (1)Fe原子核外电子数为26,根据能量最低原理书写价电子排布式;金属性越强第一电离能越小,非金属性越强第一电离能越大;K4[Fe(CN)6]中配离子为[Fe(CN)6]4-;
(2)(CN)2分子中各原子均达到稳定的电子层结构,结构简式为N≡C-C≡N;
(3)KCN沸点1497℃,熔点563℃,应属于离子晶体,离子所带电荷相等,离子半径越小,晶格能越大,离子晶体的熔点越高;
(4)①氧化石墨烯粒可与水分子形成氢键,稳定性增强;
②石墨烯中每个碳原子为三个六元环共用,利用均摊法可知每个六元环含有2个碳原子;氧化石墨烯中含有羧基、羟基,与其他碳单质性质明显不同.
解答 解:(1)Fe原子核外电子数为26,核外电子排布式为1s22s22p63s23p63d64s2,价层电子为3d64s2,
金属性越强第一电离能越小,非金属性越强第一电离能越大,故第一电离能N>C>Fe>K,
K4[Fe(CN)6]中配离子组成为[Fe(CN)6]4-,
故答案为:3d64s2;N>C>Fe>K;[Fe(CN)6]4-;
(2)(CN)2分子中各原子均达到稳定的电子层结构,结构简式为N≡C-C≡N,碳原子杂化轨道数目为2,杂化类型为sp杂化,分子中含有σ键与π键数目比为3:4,分子构型为直线形,
故答案为:sp;3:4;直线形;
(3)KCN沸点1497℃,熔点563℃,应属于离子晶体,离子所带电荷相等,钠离子半径小于钾离子半径,故NaCN的晶格能更大,故NaCN晶体的熔点更高,
故答案为:离子晶体;NaCN;
(4)①氧化石墨烯粒可与水分子形成氢键,而石墨烯不能,形成氢键使稳定性增强,
故答案为:氧化石墨烯可与水分子形成分子间氢键而石墨烯不能;
②12g石墨烯中碳原子为1mol,而石墨烯中每个碳原子为三个六元环共用,每个六元环含有2个碳原子,够形成的六元环的物质的量0.5mol,含有六元环的个数为0.5NA,
氧化石墨烯中含有羧基、羟基,与其他碳单质性质明显不同,
故答案为:0.5;氧化石墨烯.
点评 本题是对物质结构与性质的考查,涉及核外电子排布、空间结构与杂化方式判断、化学键、晶体类型与性质、氢键、晶体结构计算等,注意氢键对物质性质的影响,掌握均摊法进行晶胞有关计算.


科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
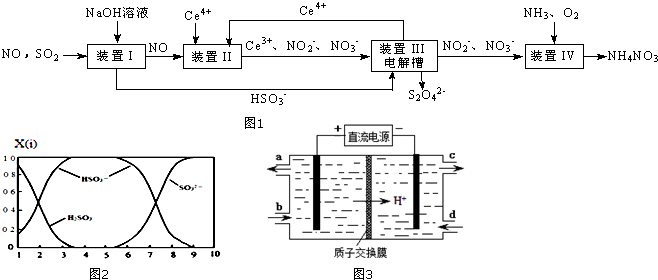
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | +45 kJ/mol | B. | +32.7 kJ/mol | C. | -45 kJ/mol | D. | 无法计算 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 时间(min) 浓度(mol•L-1) | 0 | 5 | 10 | 15 | 25 | 30 |
| NO | 1.00 | 0.58 | 0.40 | 0.40 | 0.48 | 0.48 |
| N2 | 0 | 0.21 | a | a | b | b |
| CO2 | 0 | 0.21 | a | a | 0.36 | 0.36 |
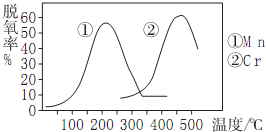
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 主族 周期 | IA | IIA | IIIA | IVA | VA | VIA | VIIA | 0 |
| 二 | ① | ② | ||||||
| 三 | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ||
| 四 | ⑨ | ⑩ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
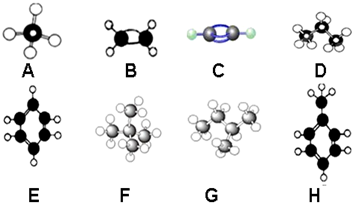
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 炭炉边放壶水,不能防止煤气中毒 | |
| B. | “水滴石穿”涉及学变化 | |
| C. | 颇受青眯的页岩气是非常规天然气,主要成分为CH4 | |
| D. | 油脂是高能量营养物质,肥胖者不能食用 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com