
| A. | 1molN2所含有的原子数为NA | |
| B. | 标准状况下,22.4L水中含有的水分子数为NA | |
| C. | Na2O2和CO2的反应中,每有1molNa2O2参加反应转移电子数为2NA | |
| D. | 16 gO2分子和16 gO3分子所含的氧原子数目相等 |
分析 A.1mol氮气分子中含有2mol单原子;
B.标准状况下水的状态不是气体;
C.该反应中过氧化钠既是氧化剂又是还原剂,1mol过氧化钠完全反应转移了1mol电子;
D.氧气和臭氧都是由O原子构成的,质量相等时含有氧原子的物质的量及数目一定相等.
解答 解:A.1molN2中含有2molN原子,含有的原子数为2NA,故A错误;
B.标准状况下水不是气体,不能使用标准状况下的气体摩尔体积计算,故B错误;
C.1mol过氧化钠与二氧化碳反应生成0.5mol氧气,转移了1mol电子,转移电子数为NA,故C错误;
D.16 gO2分子和16 gO3分子中都含有16g O原子,二者含有氧原子的物质的量、数目一定相等,故D正确;
故选D.
点评 本题考查阿伏加德罗常数的应用,题目难度中等,注意掌握好以物质的量为中心的各化学量与阿伏加德罗常数的关系,明确标准状况下气体摩尔体积的使用条件,试题培养了学生的灵活应用能力.


 全能测控期末小状元系列答案
全能测控期末小状元系列答案科目:高中化学 来源: 题型:解答题
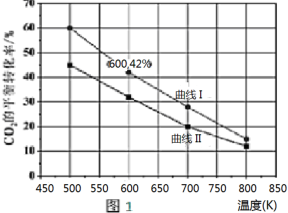 甲醇作为基本的有机化工产品和环保动力燃料具有广阔的应用前景,二氧化碳加氢合成甲醇是合理利用二氧化碳的有效途径.由二氧化碳制备甲醇过程中可能涉及反应如下:
甲醇作为基本的有机化工产品和环保动力燃料具有广阔的应用前景,二氧化碳加氢合成甲醇是合理利用二氧化碳的有效途径.由二氧化碳制备甲醇过程中可能涉及反应如下:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | AlCl3和 NaOH | B. | NaHSO4和Ba(OH)2 | C. | NaAlO2和 H2SO4 | D. | Na2CO3和盐酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1L1mol/L的HCl溶液中所含氯化氢分子数为NA | |
| B. | 标准状况下,22.4LSO3所含分子数为NA | |
| C. | 1mol 过氧化钠中阴离子所带电荷数为2NA | |
| D. | 0.1molCl2与过量稀NaOH溶液反应,转移的电子总数为0.2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 通入CH4的电极为负极 | B. | 正极发生氧化反应 | ||
| C. | 溶液中的OH-向负极移动 | D. | 工作一段时间后应补充KOH |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.1 mol/L NH4Cl溶液:c(NH4+ )=c(Cl-) | |
| B. | 0.1 mol/L NaHCO3溶液:c(OH-)+c(CO32-)=c(H+)+c(H2CO3) | |
| C. | 0.3mol/L和0.1mol/L的两醋酸溶液中H+离子浓度之比为3:1 | |
| D. | 25℃时,浓度均为0.1mol•L-1的CH3COOH和CH3COONa混合溶液的pH=4.75,则c(Na+)>c(CH3COO-)>c(H+)>c(OH-) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 热稳定性Na2CO3>NaHCO3 | |
| B. | 常温下在水中的溶解度Na2CO3>NaHCO3 | |
| C. | 与稀盐酸反应的剧烈程度Na2CO3>NaHCO3 | |
| D. | 等质量的固体与足量盐酸反应放出CO2的质量Na2CO3<NaHCO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 焰火的五彩缤纷是某些金属元素物理性质的展现 | |
| B. | PM2.5是指大气中直径接近2.5×l0-6m的颗粒物,分散在空气中形成胶体 | |
| C. | 石英用于生产光导纤维和计算机芯片 | |
| D. | 食盐、次氯酸钠溶液均可以将某些病毒氧化而达到消毒的目的 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
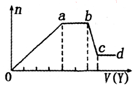 某无色稀溶液X中,可能含有如表所列离子中的某几种.取该溶液适量,向其中加入某试剂Y,产生沉淀的物质的量(n)与加入试剂体积(y)的关系如图所示.下列说法正确的是( )
某无色稀溶液X中,可能含有如表所列离子中的某几种.取该溶液适量,向其中加入某试剂Y,产生沉淀的物质的量(n)与加入试剂体积(y)的关系如图所示.下列说法正确的是( )| 阴离子 | CO32-、SiO32-、[Al(OH)4]-、Cl- |
| 阳离子 | Al3+、Fe3+、Mg2+、NH4+、Na+ |
| A. | 若Y是盐酸,则X中一定含有CO32-、SiO32-、[Al(OH)4]-和NH4+ | |
| B. | 若Y是NaOH溶液,则X中一定含有A13+、Fe3+、NH4+、Cl- | |
| C. | 若Y是NaOH溶液,则ab段发生反应的离子方程式为:NH4++OH-═NH3↑+H2O | |
| D. | 若Y是NaOH溶液,则X中的Al3+、Mg2+、NH4+物质的量之比为2:1:4 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com