
| A. | 在4mL0.1mol/L的K2Cr2O7溶液中滴加数滴1mol/LNaOH溶液,溶液颜色从橙色变成黄色 | |
| B. | 向Na2S2O3溶液中滴入足量稀硫酸,溶液最终为无色 | |
| C. | 向血红色的Fe(SCN)3溶液中加入少量KI固体,溶液颜色变浅 | |
| D. | 用50mL针筒抽取30mL红棕色的NO2气体并封住注射孔,当用力推压活塞,压缩针筒中的气体(此过程中不考虑温度变化),气体颜色逐渐变浅 |
分析 A.K2Cr2O7溶液中存在平衡:Cr2O72-(橙色)+H2O?2CrO42-(黄色)+2H+;
B.向Na2S2O3溶液中加入稀硫酸,反应生成硫单质和二氧化硫气体;
C.碘离子能还原铁离子;
D.增大气体压强,平衡向气体体积减小方向移动.
解答 解:A.K2Cr2O7溶液中存在平衡:Cr2O72-(橙色)+H2O?2CrO42-(黄色)+2H+,滴加数滴1mol/LNaOH溶液,平衡正向移动,则溶液颜色从橙色变成黄色,故A正确;
B.硫代硫酸钠与稀硫酸反应生成硫单质和二氧化硫气体,溶液出现浑浊,生成无色刺激性气味气体,反应的离子方程式为:S2O32-+2H+═SO2↑+S↓+H2O,则溶液最终为无色,故B正确;
C.碘离子能还原铁离子,则向血红色的Fe(SCN)3溶液中加入少量KI固体,铁离子浓度减小,所以溶液颜色变浅,故C正确;
D.增大气体压强,平衡向气体体积减小方向移动,即反应向生成N2O4气体的方向移动,但是由于体积减小,则NO2气体浓度仍然增大,所以气体颜色逐渐变深,故D错误.
故选D.
点评 本题考查化学平衡移动的影响因素、氧化还原反应,题目难度不大,注意把握反应过程中物质颜色的变化.


 课时训练江苏人民出版社系列答案
课时训练江苏人民出版社系列答案 黄冈经典趣味课堂系列答案
黄冈经典趣味课堂系列答案 启东小题作业本系列答案
启东小题作业本系列答案科目:高中化学 来源: 题型:选择题
| 盐酸 | 50mL | 50mL | 50mL |
| m(混合物) | 9.2g | 14.2g | 27.6g |
| V(CO2)(标准状况) | 2.2L | 3.36L | 3.36L |
| A. | 混合物中NaHCO3、KHCO的物质的量之比为1:2 | |
| B. | 当混合物质量为14.2g时,50mL盐酸恰好完全反应 | |
| C. | 盐酸的物质的量浓度为3.0mol/L | |
| D. | 9.2g混合物加热,固体质量减少2.2g |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
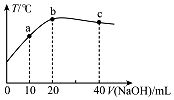 在一隔热系统中,向20.00mL 0.01000mol•L-1的醋酸溶液中逐滴加入0.01000mol.L-1的NaOH溶液,测得混合溶液的温度变化如图.下列相关说法正确的是( )
在一隔热系统中,向20.00mL 0.01000mol•L-1的醋酸溶液中逐滴加入0.01000mol.L-1的NaOH溶液,测得混合溶液的温度变化如图.下列相关说法正确的是( )| A. | 若a点溶液呈酸性,则a点有:c(CH3COO-)>c(Na+)>c(CH3COOH) | |
| B. | 从b到c:$\frac{c(C{H}_{3}COOH)}{c(C{H}_{3}CO{O}^{-})}$逐渐增大 | |
| C. | 水的电离程度:b点<c点 | |
| D. | b点有0.01000mol•L-1+c(H+)=c(Na+)-c(CH3COOH)+c(OH-) |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
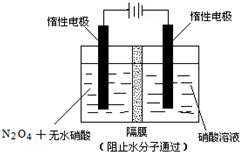 N2O5是一种新型硝化剂,其性质和制备受到人们的关注.
N2O5是一种新型硝化剂,其性质和制备受到人们的关注. .
.| t/s | 0 | 500 | 1000 |
| c(N2O5)/mol•L-1 | 5.00 | 3.52 | 2.48 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
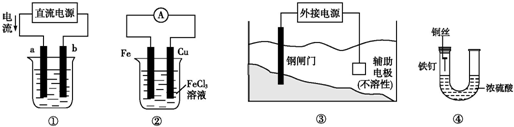
| A. | 用装置①精炼铜,则a极为精铜,电解质溶液为CuSO4溶液 | |
| B. | 装置②的总反应是:Fe+2Fe3+═3Fe2+ | |
| C. | 装置③中钢闸门应与外接电源的负极相连 | |
| D. | 装置④中的铁钉几乎没被腐蚀 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 单质钠放入水中,产生气体:Na+H2O═Na++OH-+H2↑ | |
| B. | 单质铁与稀硫酸反应:2Fe+6H+═2Fe3++3H2↑ | |
| C. | AlCl3溶液中加入过量氨水:Al3++3OH-═Al(OH)3↓ | |
| D. | Ca(HCO3)2溶液中加入少量NaOH:Ca2++OH-+HCO3-═CaCO3↓+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
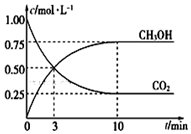 根据现代工业技术可以用H2和CO反应来生产燃料甲醇,其反应方程式如下:CO2 (g)+3H2(g)?H2O(l)+CH3OH(g)△H=-49.00kJ•mol-1
根据现代工业技术可以用H2和CO反应来生产燃料甲醇,其反应方程式如下:CO2 (g)+3H2(g)?H2O(l)+CH3OH(g)△H=-49.00kJ•mol-1查看答案和解析>>
科目:高中化学 来源: 题型:选择题
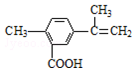
| A. | 在一定条件下,能发生取代、氧化、酯化反应 | |
| B. | 1 mol该物质最多可与2 molNa反应 | |
| C. | 1 mol该物质最多可与4 mol H2发生加成反应 | |
| D. | 1 mol该物质完全氧化最多可消耗13 mol氧气 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 分别同时滴入等浓度的盐酸,放出气体NaHCO3比Na2CO3快 | |
| B. | 热稳定性Na2CO3<NaHCO3 | |
| C. | 常温时水溶性Na2CO3<NaHCO3 | |
| D. | 相对分子质量Na2CO3<NaHCO3 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com