
 ij������ȤС��Ԥ�ⶨijNaOH��Һ��Ũ�ȣ�������������£�
ij������ȤС��Ԥ�ⶨijNaOH��Һ��Ũ�ȣ�������������£�| �ζ����� | ���������/mL | ����Һ���/mL | |
| �ζ�ǰ���� | �ζ������ | ||
| ��һ�� | 20.00 | 0.52 | 19.42 |
| �ڶ��� | 20.00 | 4.07 | 23.17 |
| ������ | 20.00 | 1.08 | 20.08 |
| c(��)��V(��) |
| V(����) |
| c(��)��c(��) |
| V(����) |
| 0.1000��0.020 |
| 0.019 |



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| H+ |
| ��ת�� |
| Fe2+ |
| �ڻ�ԭ |
| OH- |
| �۳��� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| A����״���£�22.4 L CHCl3�к��е���ԭ����ĿΪ3NA |
| B��7 g CnH2n�к��е���ԭ����ĿΪNA |
| C��18 g D2O�к��е�������ĿΪ10 NA |
| D��1 L 0.5 mol?L-1Na2CO3��Һ�к��е�CO32-��ĿΪ0.5 NA |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| A��������NaͶ��ˮ�У�2Na+2H2O=2Na++2OH-+H2�� |
| B����������Һ�м�������������Һ�����ԣ�Ba2++2OH-+2H++SO42-=BaSO4��+2H2O |
| C���Ȼ�����Һ������Ӧ��2Fe3++Fe=3Fe2+ |
| D��̼����еμ����CO32-+2H+=CO2��+H2O |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
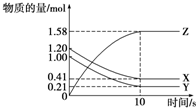 һ���¶��£���2L���ܱ������У�X��Y��Z������������ʵ�����ʱ��仯��������ͼ��ʾ������������ȷ���ǣ�������
һ���¶��£���2L���ܱ������У�X��Y��Z������������ʵ�����ʱ��仯��������ͼ��ʾ������������ȷ���ǣ�������| A����Ӧ��ʼ��10 s����Z��ʾ��ƽ����Ӧ����Ϊ0.158 mol?L-1?s-1 |
| B����Ӧ��ʼ��10 s��X�����ʵ���Ũ�ȼ�����0.79 mol?L-1 |
| C����Ӧ��ʼ��10 s��Y�����ʵ���Ũ�ȼ�����0.395 mol?L-1 |
| D����Ӧ�Ļ�ѧ����ʽΪX��g��+Y��g��?Z��g�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
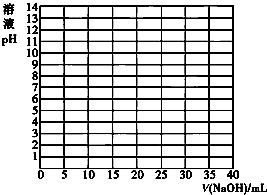 ����к͵ζ������ڲⶨ�����Һ��Ũ�ȣ�
����к͵ζ������ڲⶨ�����Һ��Ũ�ȣ�| V/��NaOH��/mL | 0.00 | 10.00 | 18.00 | 19.80 | 19.98 | 20.00 | 20.02 | 20.20 | 22.00 | 40.00 |
| ��ҺpH | 2.87 | 4.74 | 5.70 | 6.74 | 7.74 | 8.72 | 9.70 | 10.70 | 11.70 | 12.50 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
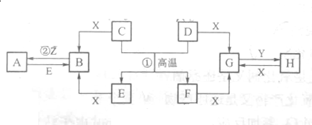 ��֪D��E��Z�ǵ��ʣ��������ǻ����D������ǿ�ᷴӦ��������ǿ�Ӧ����ʪ��Z��Ư���ԣ�Y����ɫ��Ӧ�Ի�ɫ������Ӧ���⣬������Ӧ����ˮ��Һ�н��У�ת����ϵ��ͼ��ʾ������������������ȥ����
��֪D��E��Z�ǵ��ʣ��������ǻ����D������ǿ�ᷴӦ��������ǿ�Ӧ����ʪ��Z��Ư���ԣ�Y����ɫ��Ӧ�Ի�ɫ������Ӧ���⣬������Ӧ����ˮ��Һ�н��У�ת����ϵ��ͼ��ʾ������������������ȥ�����鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
 �ֱ���Ũ��ˮ��NaOH��Һ��ȫ��Ӧ������Br2��NaOH�����ʵ����ֱ��ǣ�������
�ֱ���Ũ��ˮ��NaOH��Һ��ȫ��Ӧ������Br2��NaOH�����ʵ����ֱ��ǣ�������| A��1mol��2mol |
| B��2mol��3mol |
| C��3mol��2mol |
| D��3mol��3mol |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com