
| A. | 反应后溶液中Fe3+物质的量为0.8mol | |
| B. | 反应后产生13.44L H2(标准状况) | |
| C. | 反应后溶液中Fe2+和Fe3+物质的量之和为0.9mol | |
| D. | 由于氧化性Fe3+>H+,故反应中先没有气体产生后产生气体 |
分析 Fe(NO3)3和H2SO4的物质的量分别为0.2mol、1.5mol,n(Fe)=$\frac{39.2g}{56g/mol}$=0.7mol,氧化性为HNO3>Fe3+>H+,先发生Fe+4H++NO3-═Fe3++NO↑+2H2O、再发生Fe+2Fe3+═3Fe2+,若还有Fe剩余,则最后发生Fe与氢离子的反应,以此来解答.
解答 解:Fe(NO3)3和H2SO4的物质的量分别为0.2mol、1.5mol,n(Fe)=$\frac{39.2g}{56g/mol}$=0.7mol,氧化性为HNO3>Fe3+>H+,则
Fe+4H++NO3-═Fe3++NO↑+2H2O
1 4 1 1
0.6 2.4 0.6 0.6
Fe+2Fe3+═3Fe2+,
1 2 3
0.1 0.2 0.3
Fe完全反应,没有剩余,溶液中存在0.6molFe3+、0.3molFe2+,
A.反应后溶液中Fe3+物质的量为0.6mol,故A错误;
B.不发生Fe+2H+═Fe2++H2↑,没有氢气生成,故B错误;
C.反应后溶液中存在0.6molFe3+、0.3molFe2+,反应后溶液中Fe2+和Fe3+物质的量之和为0.9mol,故C正确;
D.氧化性为HNO3>Fe3+>H+,先发生Fe+4H++NO3-═Fe3++NO↑+2H2O,有气体生成,故D错误;
故选C.
点评 本题考查铁的化学性质及化学反应的计算,明确发生的化学反应及反应的先后是解答本题的关键,注意过量计算来解答,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | Mn02是还原剂 | B. | HCl被氧化 | ||
| C. | Mn02发生氧化反应 | D. | 4molHCl参加反应则转移4mol电子 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
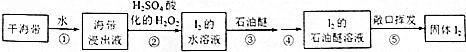
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
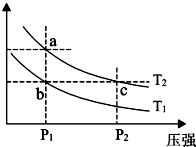 A、B、C、D、E、F六种短周期元素,其原子序数依次增大,其中 B与C同周期,D与E、F同周期,A与D 同主族,C与F同主族,C元素的原子最外层电子数是次外层电子数的三倍.又知六种元素所形成的常见单质在常温常压下有三种是气体,三种是固体.
A、B、C、D、E、F六种短周期元素,其原子序数依次增大,其中 B与C同周期,D与E、F同周期,A与D 同主族,C与F同主族,C元素的原子最外层电子数是次外层电子数的三倍.又知六种元素所形成的常见单质在常温常压下有三种是气体,三种是固体.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| n(SO₃2-):,n(HSO₃-) | 91:9 | 1:1 | 1:91 |
| PH | 8.2 | 7.2 | 6.2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
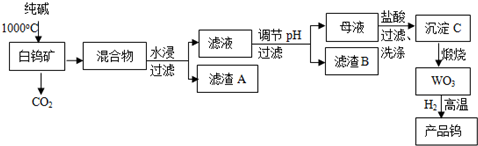
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.8mol•L-1 | B. | 0.6mol•L-1 | C. | 0.4mol•L-1 | D. | 0.2mol•L-1 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com