
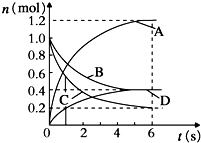
| A. | 该反应的化学方程式为3B+4D?6A+2C | |
| B. | 反应进行到1s时,v(A)=v(D) | |
| C. | 反应进行到6s时,各物质的反应速率相等 | |
| D. | 反应进行到6s时,B的平均反应速率为0.05mol/(L•s) |
分析 由图可知,B、C的物质的量减少,A、D的物质的量增加,则B、C为反应物、A、D为生成物,结合图中物质的量的变化量可知,(1-0.4):(1-0.2):(1.2-0):(0.4-0)=3:4:6:2,6s达到平衡,则反应为3B+4C?6A+2D,结合v=$\frac{△c}{△t}$及速率之比等于化学计量数之比来解答.
解答 解:A.由上述分析可知,反应为3B+4C?6A+2D,故A错误;
B.反应进行到1s时,由速率之比等于化学计量数之比可知v(A)=3v(D),故B错误;
C.反应进行到6s时,达到平衡,同种物质的正逆反应速率相等,由化学计量数可知,各物质的速率不等,故C错误;
D.反应进行到6s时,B的平均反应速率为$\frac{\frac{1mol-0.4mol}{2L}}{6s}$=0.05mol/(L•s),故D正确;
故选D.
点评 本题考查物质的量随时间变化曲线,为高频考点,把握图中物质的量的变化、平衡判断、速率关系为解答的关键,侧重分析与应用能力的考查,注意选项C为易错点,题目难度不大.


科目:高中化学 来源: 题型:推断题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 二氧化硅熔点高,可用作光导纤维 | |
| B. | 过氧化钠可与二氧化碳反应生成氧气,可用作呼吸供氧剂 | |
| C. | 明矾易溶于水,可用作净水剂 | |
| D. | 二氧化硫有氧化性,可用于漂白纸张 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
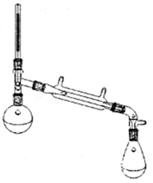 环乙烯是一种重要的化工原料,实验室常用下列反应制备环乙烯:
环乙烯是一种重要的化工原料,实验室常用下列反应制备环乙烯: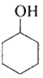 $→_{△}^{H_{2}SO_{4}}$
$→_{△}^{H_{2}SO_{4}}$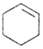 +H2O
+H2O| 物质 | 沸点(℃) | 密度(g•cm-3,20℃) | 溶解性 |
| 环己醇 | 161.1(97.8)* | 0.9624 | 能溶于水 |
| 环己烯 | 83(70.8)* | 0.8085 | 不溶于水 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na2O、Na2O2均能与盐酸反应生成NaCl,二者都是碱性氧化物 | |
| B. | Na2O2在空气中易变质,需要密封保存,Na2O性质稳定,不必密封保存 | |
| C. | 在呼吸面具中,Na2O2能做供氧剂,而Na2O不能 | |
| D. | 将Na2O2放入氢氧化钠溶液中,不发生反应,无明显现象 |
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
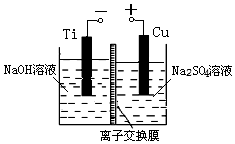 纳米级Cu2O由于具有优良的催化性能而倍受关注,表为制取纳米级Cu2O的三种方法:
纳米级Cu2O由于具有优良的催化性能而倍受关注,表为制取纳米级Cu2O的三种方法:| 方法Ⅰ | 用炭粉在高温条件下还原CuO |
| 方法Ⅱ | 电解法,反应为2Cu+H2O $\frac{\underline{\;电解\;}}{\;}$ Cu2O+H2↑. |
| 方法Ⅲ | 用肼(N2H4)还原新制Cu(OH)2 |
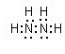 ,肼易溶于水,它是与氨类似的弱碱,用电离方程式表示肼的水溶液显碱性的原因N2H4+H2O?N2H5++OH-.
,肼易溶于水,它是与氨类似的弱碱,用电离方程式表示肼的水溶液显碱性的原因N2H4+H2O?N2H5++OH-.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
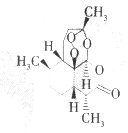 中国中医研究院终身研究员兼首席研究员屠呦呦于1971年首先从黄花蒿中发现抗疟有效提取物,1972年分离出新型结构的抗疟有效成分青蒿素,拯救了数千万人的生命.青蒿素的分子结构如图.下列说怯错误的是( )
中国中医研究院终身研究员兼首席研究员屠呦呦于1971年首先从黄花蒿中发现抗疟有效提取物,1972年分离出新型结构的抗疟有效成分青蒿素,拯救了数千万人的生命.青蒿素的分子结构如图.下列说怯错误的是( )| A. | 青蒿素的分子式为C15H22O5 | |
| B. | 青蒿素是芳香族化合物 | |
| C. | 青蒿素分子中含有过氧链、酯基和醚键 | |
| D. | 青蒿素不能发生加成反应 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com