
| A. | 原子半径:A>B>D>C | B. | 原子的最外层电子数目:A>B>D>C | ||
| C. | 原子序数:d>c>b>a | D. | 离子半径:C2->D->B+>A2+ |
分析 短周期元素的离子:aA2+、bB+、cC2-、dD-都具有相同的电子层结构,所以有:a-2=b-1=c+2=d+1,且A、B在周期表中C、D的下一周期,原子序数:a>b>d>c,结合元素周期律递变规律解答该题.
解答 解:短周期元素的离子:aA2+、bB+、cC2-、dD-都具有相同的电子层结构,所以有:a-2=b-1=c+2=d+1,且A、B在周期表中C、D的下一周期,原子序数:a>b>d>c,
A.原子的电子层数越多,则原子半径越大,且同一周期元素,原子半径随着原子序数增大而减小,所以原子半径B>A>C>D,故A错误;
B.A原子最外层电子数是2、B原子最外层电子数是1、C原子最外层电子数的6、D原子最外层电子数是7,所以原子的最外层电子数目:D>C>A>B,故B错误;
C.这四种离子电子层结构相同,所以a-2=b-1=c+2=d+1,则a>b>d>c,故C错误;
D.电子层结构相同的离子,离子半径随着原子序数增大而减小,所以离子半径:C2->D->B+>A2+,故D正确;
故选D.
点评 本题考查原子结构和元素周期律,为高频考点,侧重考查学生分析判断能力,正确判断原子序数是解本题关键,知道离子半径、原子半径大小比较方法,题目难度不大.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 一定互为同系物 | B. | 一定互为同分异构体 | ||
| C. | 碳氢原子最简单整数比相同 | D. | 只能是同种物质 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
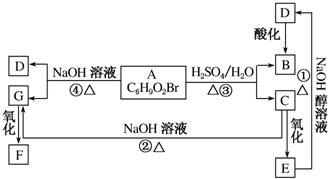
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
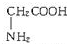 、丙氨酸
、丙氨酸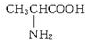 、半胱氨酸
、半胱氨酸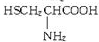 三种氨基酸.现称取该多肽830g,完全水解后共得到1010g氨基酸,经分析该氨基酸混合物的平均相对分子质量为100,问:
三种氨基酸.现称取该多肽830g,完全水解后共得到1010g氨基酸,经分析该氨基酸混合物的平均相对分子质量为100,问:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②③⑤⑧ | B. | ②④⑥⑦⑧ | C. | ①③⑤⑥⑦ | D. | ①②④⑧ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 对肾功能衰竭病人进行“血液透析” | |
| B. | 用热的纯碱溶液清除餐具上沾有的油污 | |
| C. | 常温下用铝罐贮藏贮运浓硫酸 | |
| D. | 对石油进行分馏,裂化获得汽油 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 通入甲烷的电极为电池的正极,通入氧气的电极为负极 | |
| B. | 在标准状况下,每消耗5.6 L O2,可向外提供8.3×104 C的电量 | |
| C. | 通入甲烷电极的电极反应为:CH4+10OH--8e-═CO32-+7H2O | |
| D. | 放电一段时间后,溶液pH升高 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Y元素最高价氧化物对应水化物的化学式为HYO4 | |
| B. | 原子半径由小到大的顺序为W<X<Z | |
| C. | X与W可形成W2X、W2X2两种物质 | |
| D. | Y2与W2在冷暗处爆炸 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com