
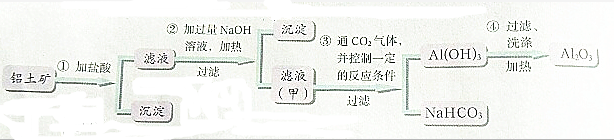
| ||
| ||


 快乐小博士巩固与提高系列答案
快乐小博士巩固与提高系列答案科目:高中化学 来源: 题型:
| A、分液时,分液漏斗下层液体从下口放出,上层液体从上口倒出 |
| B、蒸馏时,应使温度计水银球靠近蒸馏烧瓶支管口 |
| C、向碘水中加入适量酒精,可以将碘单质萃取出来 |
| D、蒸发时,当溶液中出现大量晶体时,停止加热余热蒸干 |
查看答案和解析>>
科目:高中化学 来源: 题型:
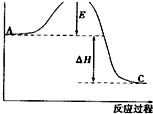 2SO2(g)+O2(g)?2SO3(g)反应过程的能量变化如图所示.请回答下列问题:
2SO2(g)+O2(g)?2SO3(g)反应过程的能量变化如图所示.请回答下列问题:| 1 |
| 3 |
| 1 |
| 3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
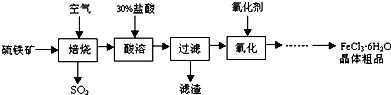
查看答案和解析>>
科目:高中化学 来源: 题型:
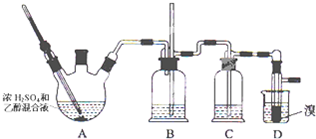
| 乙醇 | 1,2-二溴乙烷 | 乙醚 | |
| 状态 | 无色液体 | 无色液体 | 无色液体 |
| 密度/g?cm-3 | 0.79 | 2.2 | 0.71 |
| 沸点/℃ | 78.5 | 132 | 34.6 |
| 熔点/℃ | -l30 | 9 | -1l6 |
查看答案和解析>>
科目:高中化学 来源: 题型:

| A、该装置中铜为阳极 |
| B、当铜片的质量变化了12.8 g时,a极上消耗的O2在标准状况下的体积为2.24 L |
| C、该装置中b极的电极反应式是:H2+2OH--2e-═2H2O |
| D、该装置中a极为正极,发生氧化反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、用浓氨水和氢氧化钠制取氨气 |
| B、加热蒸干AlCl3溶液不能得到无水AlCl3 |
| C、工业上SO2和O2在常压下生成SO3 |
| D、水中的c(H+)比0.1 mol/LNaOH溶液中的大 |
查看答案和解析>>
科目:高中化学 来源: 题型:
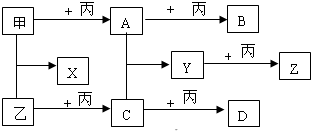
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com