
| A. | $\frac{m}{32}$ mol-1 | B. | 16m mol-1 | C. | m mol-1 | D. | 32m mol-1 |
分析 根据n=$\frac{m}{M}$计算出1g氧气的物质的量,然后根据N=nNA计算出可知:NA=$\frac{N}{n}$,据此可计算出阿伏伽德罗常数.
解答 解:1g氧气的物质的量为:$\frac{1g}{32g/mol}$=$\frac{1}{32}$mol,
$\frac{1}{32}$mol氧气分子中含有mg分子,则阿伏伽德罗常数NA=$\frac{N}{n}$=$\frac{m}{\frac{1}{32}mol}$=32m mol-1,
故选D.
点评 本题考查了物质的量的计算,题目难度不大,明确阿伏伽德罗常数的概念及表达式即可解答,注意熟练掌握物质的量与摩尔质量、阿伏伽德罗常数等之间的转化关系,试题培养了学生的分析能力及化学计算能力.


科目:高中化学 来源: 题型:选择题
| A. | pH=1的溶液中:Na+、K+、MnO4-、CO32- | |
| B. | c(H+)=1×10-13mol/L的溶液中:K+、Na+、NO3-、CH3COO- | |
| C. | 0.1mol•L-1NH4HCO3溶液:Na+、Fe3+、NO3-、Cl- | |
| D. | 0.1mol•L-1FeCl3溶液:Fe2+、NH4+、SCN-、SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氧化物、氢化物都是只含二种元素 | |
| B. | 混合物中的元素一定是化合态的形式存在 | |
| C. | 金属氧化物一定是碱性氧化物 | |
| D. | 由一种元素组成的物质一定是纯净物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | pH=1的溶液中:K+、NO3-、SO32-、Na+ | |
| B. | 使石蕊呈红色的溶液中:Na+、HCO3-、NO3-、AlO2- | |
| C. | 使pH试纸显红色的溶液中:Cu2+、Fe3+、NO3-、SO42- | |
| D. | 在酸性溶液中:NH4+、Na+、Cu2+、ClO- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 维生素B5: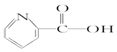 | B. | 阿司匹林: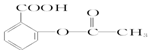 | ||
| C. | 芬必得: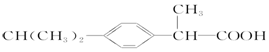 | D. | 摇头丸: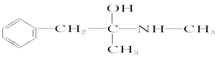 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 第一步 | B. | 第二步 | C. | 第三步 | D. | 第四步 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
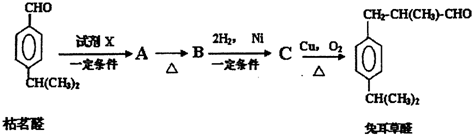

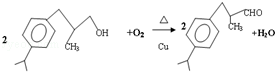 .
. 、
、 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
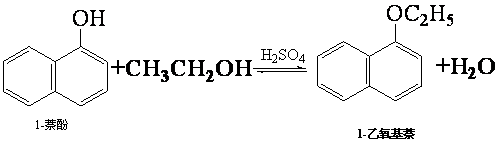
| 物质 | 相对分 子质量 | 状态 | 熔点(℃) | 沸点(℃) | 溶解度 | |
| 水 | 乙醇 | |||||
| 1-萘酚 | 144 | 无色或黄色菱形结晶或粉末 | 96℃ | 278℃ | 微溶于水 | 易溶于乙醇 |
| 1-乙氧基萘 | 172 | 无色液体 | 5.5℃ | 267℃ | 不溶于水 | 易溶于乙醇 |
| 乙醇 | 46 | 无色液体 | -114.1℃ | 78.5℃ | 任意比混溶 | |
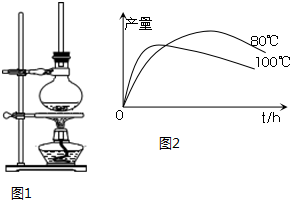
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com