

分析 (1)树状分类法是一种很形象的分类法,按照层次,一层一层来分,就像一棵大树,有叶、枝、杆、根;
氧化钙、氧化钠为金属氧化物,二氧化硅为非金属氧化物;氢氧化铝为两性氢氧化物,其余两种为碱;
CO32-+2H+═CO2↑+H2O表示可溶性碳酸盐和可溶性强酸或者可溶性强酸的酸式盐反应生成二氧化碳和水、可溶性盐;
(2)①实验室用氯化铵和氢氧化钙固体在加热条件下反应制备氨气;
②该装置可以制备固体+固体反应,条件是加热的气体的制备;
③棉花团可以防止生成的氨气与空气形成对流;
④依据氨气极易溶于水,密度小于空气密度选择收集方法;氨气为碱性气体,应选择碱性干燥剂干燥;
氨气与水反应生成一水合氨,一水合氨电离生成氢氧根离子,溶液显碱性,能够使红色石蕊试纸变蓝.
解答 解:(1)依据图例可知该分类方法属于树状分类法;Al(OH)3、KOH、Ba(OH)2,三种物质中只有氢氧化铝为两性氢氧化物,其余两种为碱;
氧化钙、氧化钠为金属氧化物,二氧化硅为非金属氧化物;
碳酸钠与盐酸反应实质是碳酸根离子与氢离子反应生成二氧化碳和水,离子方程式:CO32-+2H+═CO2↑+H2O,其化学方程式为:Na2CO3+2HCl═2NaCl+H2O+CO2↑;
故答案为:B;SiO2;Al(OH)3;Na2CO3+2HCl═2NaCl+H2O+CO2↑;
(2)①氯化铵和氢氧化钙固体在加热条件下反应生成氯化钙、氨气和水,化学方程式:
2NH4Cl+Ca(OH)2 $\frac{\underline{\;\;△\;\;}}{\;}$ CaCl2+NH3↑+2H2O;
故答案为:2NH4Cl+Ca(OH)2 $\frac{\underline{\;\;△\;\;}}{\;}$ CaCl2+2NH3↑+2H2O;
②氯酸钾在二氧化锰催化剂条件下加热生成氧气,可以用此装置制备;
故答案为:O2;
③棉花团可以防止生成的氨气与空气形成对流;
故答案为:防止形成对流;
④氨气易溶于水,密度小于空气密度,所以只能用向下排气法,氨气为碱性气体,应选择碱性干燥剂,碱石灰为碱性干燥剂,可以用来干燥氨气;
氨气与水反应生成一水合氨,一水合氨电离生成氢氧根离子,溶液显碱性,能够使红色石蕊试纸变蓝,所以检验氨气可以用:润湿的红色石蕊试纸靠近管口变蓝;
故答案为:向下排气法;碱石灰;润湿的红色石蕊试纸靠近管口变蓝.
点评 本题考查了物质分类的方法、氨气的实验室制法,题目难度不大,熟悉物质的性质、明确氨气制备的原理是解题关键,注意气体发生装置的选择原则.


科目:高中化学 来源: 题型:选择题
| 元素代号 | L | M | Q | R | T |
| 原子半径/nm | 0.160 | 0.143 | 0.112 | 0.104 | 0.066 |
| 主要化合价] | +2 | +3 | +2 | +6、-2 | -2 |
| A. | 氢化物的沸点为H2T<H2R | B. | 单质与稀盐酸反应的速率为L<Q | ||
| C. | L2+与R2-的核外电子数相等 | D. | M与T形成的化合物具有两性 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | n+11 | B. | n-5 | C. | n+3 | D. | n-6 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 通常状况下,氨气的溶解度较大 | |
| B. | 氨水中的NH3•H2O电离出少量的OH- | |
| C. | 溶于水的氨气生成的少量NH3•H2O全部电离生成OH- | |
| D. | 氨气本身的碱性弱 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 具有同质量、不同体积的N2O和CO2 | B. | 具有同温度、同体积的CO和N2 | ||
| C. | 具有同体积、同密度的SO2和NO2 | D. | 具有同密度、不同质量的O2和O3 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | NiMH 电池放电过程中,正极的电极反应式为:NiOOH+H2O+e-=Ni(OH)2+OH- | |
| B. | 充电过程中OH-离子从阳极向阴极迁移 | |
| C. | 充电过程中阴极的电极反应式:H2O+M+e-=MH+OH-,H2O中的H被M还原 | |
| D. | 放电是OH-离子从正极向负极迁移 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
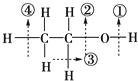
| A. | 与金属钠反应时键①断裂 | |
| B. | 与乙酸发生酯化反应时键①断裂 | |
| C. | 与浓硫酸共热到170℃时键③、④断裂 | |
| D. | 在铜催化下与氧气反应时键①、③断裂 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 按系统命名法,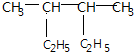 的名称是2,3-二乙基丁烷 的名称是2,3-二乙基丁烷 | |
| B. | 主链有4个碳原子,且总碳原子数≤6的烷烃共有10种 | |
| C. | 结构片段为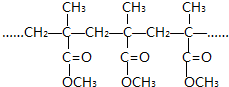 的高聚物,是由其单体通过缩聚反应生成的 的高聚物,是由其单体通过缩聚反应生成的 | |
| D. | 等质量的乙烯和聚乙烯完全燃烧,产生的二氧化碳的质量比为1:1 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com