
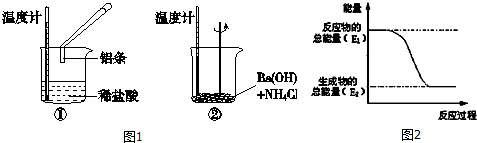
分析 (1)化学反应中,温度升高,则反应放热;温度降低则反应吸热;图2中反应物总能量大于生成物总能量,该反应为放热反应,据此进行解答;
(2)①自发进行的放热的氧化还原反应能设计成原电池;
②该原电池中,失电子的金属单质作负极,不如Cu活泼的金属或导电的非金属性作正极,电解质溶液为可溶性的氯化铁溶液,负极上Cu失电子发生氧化反应、正极上铜离子得电子发生还原反应;
解答 解:(1)Al与HCl反应后,温度升高,则说明反应放热,Ba(OH)2•8H2O与NH4Cl的反应温度降低,说明反应为吸热反应;
反应①为放热反应,反应物的总能量大于生成物的总能量,所以①的能量变化可用图2表示;
故答案为:放;吸;①;
(2)①自发进行的放热的氧化还原反应能设计成原电池,A反应中没有电子转移,不属于氧化还原反应,所以不能设计成原电池;B属于自发进行的放热的氧化还原反应,所以能设计成原电池,
故答案为:B;
②该原电池中,Cu失电子作负极,不如Cu活泼的金属或导电的非金属性作正极,电解质溶液为可溶性的氯化铁溶液,正极上铜离子得电子发生还原反应,电极反应式为:2Fe3++2e-=2Fe2+,负极上Cu失电子发生氧化反应,电极反应式为:Cu-2e-═Cu2+;
故答案为:正极:2Fe3++2e-=2Fe2+;负极:Cu-2e-=Cu2+;
点评 本题考查学生根据实验现象判断放热与吸热反应,原电池设计,难度不大,侧重于基础知识的考查,注意把握实验原理.


科目:高中化学 来源: 题型:选择题
| A. | 离子化合物可能含共价键 | B. | 共价化合物可能含离子键 | ||
| C. | 离子化合物中只含离子键 | D. | 共价化合物中可能含共价键 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
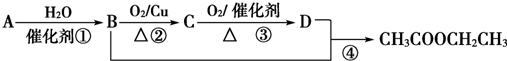
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | HCl的电子式为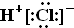 | B. | Cl-的结构示意图 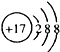 | ||
| C. | CO2的电子式 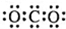 | D. | 质量数为37的氯原子 ${\;}_{37}^{17}$Cl |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 关于该粒子的说法不正确的是( )
关于该粒子的说法不正确的是( )| A. | 核电荷数为17 | B. | 核外有3个电子层 | ||
| C. | 属于非金属元素原子 | D. | 在化学反应中容易失去1个电子 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | M>N | B. | M<N | C. | M=N | D. | 无法判断 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NH4Cl?NH4++Cl- | B. | H2S?2H++S2- | ||
| C. | KHCO3?K++H+++CO3- | D. | CH3COONH4=NH4++CH3COO- |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 甲醛 | B. | 乙醛 | C. | 丁醛 | D. | 戊醛 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com