
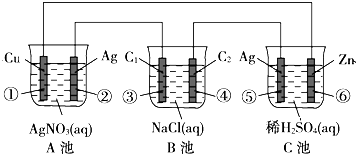
分析 (1)C是能自发进行的氧化还原反应,且符合原电池的构成条件,所以属于原电池,A、C有外接电源,属于电解池;
(2)A电解池中,Ag作阳极,阳极Ag失去电子发生氧化反应,C原电池中,Zn为负极失去电子生成锌离子;
(3)①银离子得到电子生成银,⑥锌失去电子生成锌离子,据此进行计算电极的质量变化.
解答 解:(1)C是能自发进行的氧化还原反应,且符合原电池的构成条件,所以属于原电池,B有外接电源,属于电解池,A为电解池或电镀池,
故答案为:电镀池(电解池);原电池;
(2))②为电解池的阳极,Ag失去电子生成银离子,电极方程式为:Ag++e-=Ag,
C为原电池,Zn为负极,反应中失去电子生成锌离子,电极方程式为Zn-2e-=Zn2+,
故答案为:Ag++e-=Ag;Zn-2e-=Zn2+;
(3)当电路上有1mol电子流过时,
①中铜电极上银离子得电子析出,电极反应式为:Ag++e-=Ag,当电路上有1mol电子流过时析出银的质量为:1mol×108g/mol=108g
⑥锌被氧化,电极反应式为:Zn-2e-=Zn2+,当电路上有1mol电子流过时,锌减少的质量为$\frac{1mol}{2}$×65g/mol=32.5g,
故答案为:增加108g;减少32.5g.
点评 本题考查了原电池和电解池原理的综合应用,题目难度中等,正确判断原电池和电解池是解本题关键,电极反应式的书写是学习难点,注意掌握电解池和原电池工作原理.


 夺冠训练单元期末冲刺100分系列答案
夺冠训练单元期末冲刺100分系列答案 新思维小冠军100分作业本系列答案
新思维小冠军100分作业本系列答案 名师指导一卷通系列答案
名师指导一卷通系列答案科目:高中化学 来源: 题型:解答题
| 化学式 | 电离平衡常数 |
| HCN | K=4.9×10-10 |
| CH3COOH | K=1.8×10-5 |
| H2CO3 | K1=4.4×10-7,K2=4.7×10-11 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 反应后所得溶液的溶质是强酸弱碱盐 | |
| B. | 弱酸溶液和强碱溶液反应 | |
| C. | 强酸溶液和弱碱溶液反应 | |
| D. | 一元强酸溶液和一元强碱溶液反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 二氧化碳的分子式: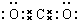 | |
| B. | Cl-的结构示意图: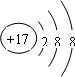 | |
| C. | 乙烯的结构简式:CH2CH2 | |
| D. | 质子数为53、中子数为78 的碘原子:${\;}_{53}^{131}$I |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 氯化铜溶液与铁粉反应:Cu2++Fe═Fe3++Cu | |
| B. | NaHSO4溶液与氢氧化钠溶液反应:OH-+H+═H2O | |
| C. | 氢氧化钡溶液与稀 H2SO4 反应:Ba2++SO42-═BaSO4↓ | |
| D. | 碳酸钙与盐酸反应:CaCO3+2H+═H2O+CO2↑+Ca2+ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
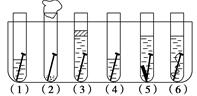 取6根铁钉、6支洁净试管及其他材料,按图所示准备.
取6根铁钉、6支洁净试管及其他材料,按图所示准备.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用镊子夹取钠块,吸干表面的煤油后,用小刀切下一部分进行实验.剩余的钠应放回原试剂瓶 | |
| B. | 钠加热后先熔化成小球状,这是因为金属钠的熔点较低 | |
| C. | 钠燃烧时火焰呈黄色,这与钠元素的焰色反应有关 | |
| D. | 钠块表面若有部分已被氧化为Na2O,充分燃烧后将得到Na2O和Na2O2的混合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com