
分析 某液态化合物甲由元素X、Y组成,该化合物能在氧气中燃烧.生成元素X和Y的氧化物乙和丙,已知甲、乙、丙均为AB2型化合物,且化合物乙和丙均能使澄清石灰水变浑浊,乙、丙分别为SO2、CO2中的一种,则甲为CS2.乙、丙混合气体的相对分子质量为2.56×22.4≈57.3,而生成SO2、CO2的物质的量之比为2:1,平均相对分子质量为$\frac{64×2+44}{2+1}$≈57.3,验证符合,若化合物甲的分子中X、Y两元素的质量比是3:16,则X为C元素、Y为S元素.乙、丙混合气体的物质的量为$\frac{0.672L}{22.4L/mol}$=0.03mol,结合氧原子守恒计算参加反应氧气物质的量.
解答 解:某液态化合物甲由元素X、Y组成,该化合物能在氧气中燃烧.生成元素X和Y的氧化物乙和丙,已知甲、乙、丙均为AB2型化合物,且化合物乙和丙均能使澄清石灰水变浑浊,乙、丙分别为SO2、CO2中的一种,则甲为CS2.乙、丙混合气体的相对分子质量为2.56×22.4≈57.3,而生成SO2、CO2的物质的量之比为2:1,平均相对分子质量为$\frac{64×2+44}{2+1}$≈57.3,验证符合.
(1)乙、丙混合气体的物质的量为$\frac{0.672L}{22.4L/mol}$=0.03mol,根据原子守恒可知n(O2)=n(SO2)+n(CO2)=0.03mol,
故答案为:0.03mol;
(2)甲为CS2,摩尔质量为76g/mol,
故答案为:76g/mol;
(3)若化合物甲的分子中X、Y两元素的质量比是3:16,则X为C元素、Y为S元素,化合物甲在氧气中燃烧的化学反应方程式为CS2+3O2$\frac{\underline{\;点燃\;}}{\;}$2SO2+CO2,
故答案为:C、S;CS2+3O2$\frac{\underline{\;点燃\;}}{\;}$2SO2+CO2.
点评 本题考查无机物推断,澄清石灰水变浑浊的气体为突破口,(1)注意利用守恒法计算解答,侧重考查学生分析能力.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:选择题
| A. | 乙烷与氯气制备一氯乙烷 | |
| B. | 在FeBr3催化作用下,苯与液溴反应制取溴苯 | |
| C. | 苯和硝酸反应制备硝基苯 | |
| D. | 乙烯与氧气在银催化作用下生成环氧乙烷 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
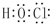 .
.查看答案和解析>>
科目:高中化学 来源: 题型:推断题
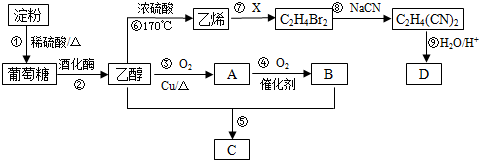
 CH3COOCH2CH3+H2O.
CH3COOCH2CH3+H2O.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
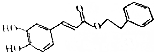 咖啡酸苯乙酯是蜂胶的主要成分,因具有极强的抗炎和抗氧化活性得以在食品、医学以及其他领城广泛应用,其分子结构简式如图.下列关于咖啡酸苯乙酯的说法不正确的是( )
咖啡酸苯乙酯是蜂胶的主要成分,因具有极强的抗炎和抗氧化活性得以在食品、医学以及其他领城广泛应用,其分子结构简式如图.下列关于咖啡酸苯乙酯的说法不正确的是( )| A. | 咖啡酸苯乙酯的分子式为C17H16O4 | |
| B. | 咖啡酸苯乙酯可以发生水解、取代、消去反应 | |
| C. | 1mol咖啡酸苯乙酯最多可与7mol H2反应 | |
| D. | 1mol咖啡酸苯乙酯最多可与4mol Br2反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
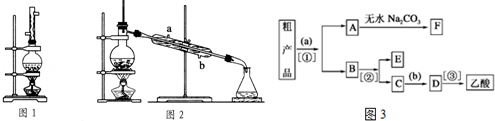
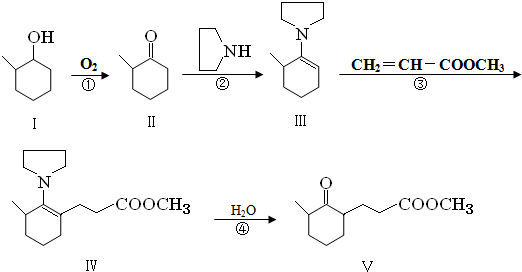
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
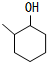 +O2 $→_{△}^{催化剂}$ 2
+O2 $→_{△}^{催化剂}$ 2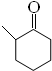 +2H2O(不要求注明反应条件).
+2H2O(不要求注明反应条件).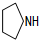 .
.查看答案和解析>>
科目:高中化学 来源: 题型:推断题
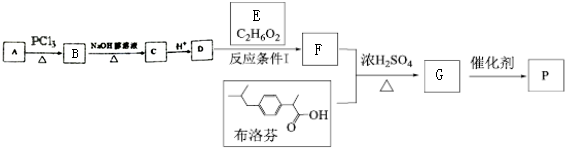
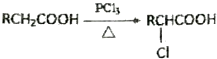
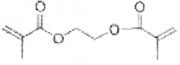 .
. .
.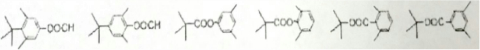 任意2种:①含有苯环和酯基;②其核磁共振氢谱为4组峰,且峰面积比为9:6:2:1.
任意2种:①含有苯环和酯基;②其核磁共振氢谱为4组峰,且峰面积比为9:6:2:1.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com